
【题目】食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯![]()

![]() 具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________
具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________![]() 写结构简式
写结构简式![]() 发生加聚反应生成的,该物质的分子构型是__________________________。
发生加聚反应生成的,该物质的分子构型是__________________________。
(2)劣质植物油中的亚油酸![]() 含量很低,下列关于亚油酸的说法中,正确的是_________。
含量很低,下列关于亚油酸的说法中,正确的是_________。
A.分子式为![]()
B.一定条件下能与甘油![]() 丙三醇
丙三醇![]() 发生酯化反应
发生酯化反应
C.能和NaOH溶液反应
![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
(3)假酒中甲醇![]() 含量超标,请写出Na和甲醇反应的化学方程式:________。
含量超标,请写出Na和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
【答案】![]() 平面型
平面型 ![]()
![]() 氨基酸 取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解
氨基酸 取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解
【解析】
(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可;乙烯为平面型分子;
(2)根据结构式可分析结果;
(3)Na和甲醇反应生成甲醇钠和氢气;
(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸;
(5)淀粉若完全水解,加入碘水溶液不变蓝色。
(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可,其单体为![]() ,乙烯为平面型分子,
,乙烯为平面型分子,![]() 也为平面型分子,故答案为:
也为平面型分子,故答案为:![]() ;平面型;
;平面型;
(2)A. 由结构式可知分子式为![]() ,A项错误;
,A项错误;
B.含有羧基能与甘油发生酯化反应,B项正确;
C.含有羧基能与氢氧化钠发生中和反应,C项正确;
D.含有碳碳双键能使酸性![]() 溶液褪色,D项错误,故选:BC;
溶液褪色,D项错误,故选:BC;
(3)Na和甲醇反应生成甲醇钠和氢气,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸,故答案为:氨基酸;
(5)淀粉若完全水解,加入碘水溶液不变蓝色,可设计方案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解,故答案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解。


科目:高中化学 来源: 题型:
【题目】2014年3月22日是第二十二届“世界水日”,保护水资,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。[Au(CN)2]+的一级电离方程式:__________________________;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,其反应的离子方程式为: _______________________________________________ 。
和N2,其反应的离子方程式为: _______________________________________________ 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_______________________________。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)_________________(若不存在,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有的种类(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有的种类(不考虑立体异构)
A. 9B. 6C. 5D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )

A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O

请回答:
(1)甲池是___,通入O2的电极作为___极,电极反应式为_______.
(2)乙池是_____,A电极名称为__极,电极反应式为_________.
乙池中的总反应离子方程式为_________,一段时间后溶液的pH______(填“增大”、“减小”或“不变”).
(3)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2____mL(标准状况下).当丙为硫酸铜溶液且体积为500 mL,通电后丙溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
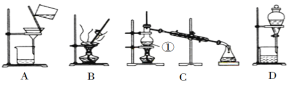
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__,装置B中玻璃棒的作用是__,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__,①中加入沸石的作用是__,冷却水的方向是__。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置__。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__,不产生白色沉淀表明Cl已除净。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com