
(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
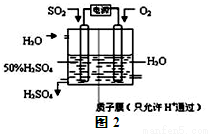
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
(1)① 66.7% 1.25 c ② T2 ③ 0<x<0.8
(2)2SO2+O2+2H2O=2H2SO4 SO2+2H2O -2e- = SO42-+4H+
【解析】
试题分析:(1)①在8min时反应达平衡,SO3的物质的量减小了0.4mol,SO3的转化率α=
 ×100%= 66.7%;T1℃反应达平衡时, 反应达平衡的物质的量0.2mol,同时生成0.2mol O2和0.4mol SO2,c(SO3)=0.2mol /L,c(O2)= 0.2mol /L ,c(SO2)= 0.4mol /L,所以2SO2(g)+O2(g)
×100%= 66.7%;T1℃反应达平衡时, 反应达平衡的物质的量0.2mol,同时生成0.2mol O2和0.4mol SO2,c(SO3)=0.2mol /L,c(O2)= 0.2mol /L ,c(SO2)= 0.4mol /L,所以2SO2(g)+O2(g)  2SO3(g)的平衡常数k=0.2mol /L×(0.4mol /L)2÷(0.2mol /L)2=0.8,则2SO3(g)
2SO3(g)的平衡常数k=0.2mol /L×(0.4mol /L)2÷(0.2mol /L)2=0.8,则2SO3(g)  2SO2(g)+O2(g)的平衡常数=1/k= 1.25。②由△H<0,升高温度平衡逆向移动,平衡常数减小,即温度越低平衡常数越大,所以温度最低的是T2。③要使SO3的浓度减小,平衡逆向移动,计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行。Qc=(0.2mol /L)2÷[X×(0.2mol /L)2]>1.25,解得X<0.8,即x的取值范围是0<x<0.8。(2)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;总反应的化学方程式为2SO2+O2+2H2O=2H2SO4,阳极电极反应为:SO2+2H2O=SO42-+4H++2e-。
2SO2(g)+O2(g)的平衡常数=1/k= 1.25。②由△H<0,升高温度平衡逆向移动,平衡常数减小,即温度越低平衡常数越大,所以温度最低的是T2。③要使SO3的浓度减小,平衡逆向移动,计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行。Qc=(0.2mol /L)2÷[X×(0.2mol /L)2]>1.25,解得X<0.8,即x的取值范围是0<x<0.8。(2)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;总反应的化学方程式为2SO2+O2+2H2O=2H2SO4,阳极电极反应为:SO2+2H2O=SO42-+4H++2e-。
考点:考查化学平衡计算。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,
在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
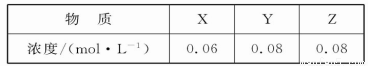
下列说法正确的是
A.此时v(正)<v(逆)
B.平衡时Y的浓度为0.05 mol·L-1
C.平衡时X的转化率为40%
D.增大压强使平衡向正反应方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:计算题
(4分)将4.48LHCl气体(标准状况下)通入水中配成500mL溶液,问此盐酸溶液的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列溶液中含Cl-浓度最大的是
A、10mL0.1mol/L的AlCl3溶液 B、20mL0.1mol/LCaCl2溶液
C、30mL0.2mol/L的KCl溶液 D、100mL0.25mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列物质中,能够导电的电解质是
A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是

A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
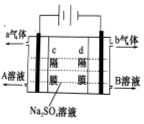
A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
B.A溶液为硫酸,B溶液为氢氧化钠
C.a气体为氢气,b气体为氧气
D.该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:实验题
(16分)实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。
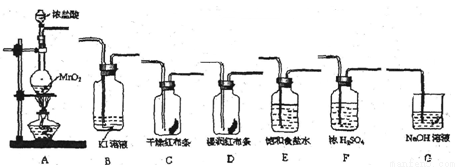
(1)上述装置中各仪器从左至右的连接顺序为A接 接 接 接 接 接G。
(2)E装置的作用是 ,D中的现象为 ,
B中的现象为________________________。
(3)写出相关反应的离子方程式:A中 ,
G中 。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3- 物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com