
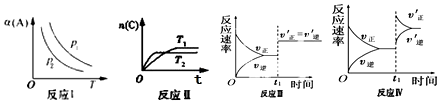
| A. | 反应 I:若 p1>p2,则 a+b<c | |
| B. | 反应Ⅱ:此反应的△H<0,且 T1<T2 | |
| C. | 反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响 | |
| D. | 反应Ⅳ:表示t1时刻增大 B 的浓度对反应速率的影响 |
分析 A.若 p1>p2,可知压强越大,A的转化率越大,则增大压强,平衡正向移动;
B.由图可知T1<T2,温度高时C的物质的量小,可知升高温度平衡逆向移动;
C.若a+b=c,增大压强时正逆反应速率同等程度增大;
D.增大 B 的浓度,瞬间逆反应速率不变.
解答 解:A.若 p1>p2,可知压强越大,A的转化率越大,则增大压强,平衡正向移动,则a+b>c,故A错误;
B.由图可知T1<T2,温度高时C的物质的量小,可知升高温度平衡逆向移动,则此反应的△H<0,故B正确;
C.若a+b=c,增大压强时正逆反应速率同等程度增大,则催化剂、加压均符合图中速率变化,故C错误;
D.增大 B 的浓度,瞬间逆反应速率不变,与图中逆反应速率瞬间增大不符,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、压强、浓度对平衡移动的原理为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
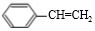
| A. | 苯与液溴在FeBr3催化作用下生成溴苯的反应 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2 | |
| C. | 乙酸与乙醇生成乙酸乙酯的反应 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
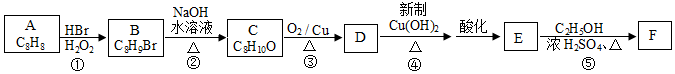
 .
.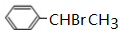 .
.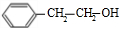 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2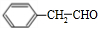 +2H2O、
+2H2O、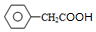 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$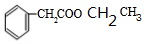 +H2O.
+H2O.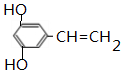 .
.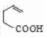 制备
制备 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③ | C. | ⑤⑥ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
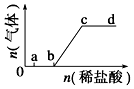 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| C. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
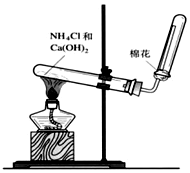 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com