
����Ŀ����֪A��B��C��DΪ�ɶ�����Ԫ����ɵ��������ʣ�������������ʾת����ϵ����DΪǿ�����(����������ʿ���ʡ��)��
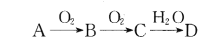
����˵������ȷ����
A. ��AΪ�ǽ������ʣ�������Mg��Ӧ�IJ��������������Ӹ����ȿ���Ϊ2:3
B. ��AΪ�ǽ������ʣ��������Ԫ�������ڱ��е�λ�ÿ��ܴ��ڵڶ����ڵ�IVA��
C. ��A�ǹ��ۻ������A��D�п��ܷ���������ԭ��Ӧ
D. ��A�ǽ�����ǽ������ʣ�������0. 1 mol/L��D��Һ����ˮ�������c(H+)����Ϊ10-13mol/L
���𰸡�B
��������
��ѧ����������N��SԪ�ص��ʻ��������ת����ϵ��NaԪ�ص��ʻ��������ת����ϵ��
A����AΪ�ǽ������ʵ�����������Mg��Ӧ�IJ���ΪMg3N2���������Ӹ�����Ϊ2��3��A����ȷ��
B����A�����Ԫ��Ϊ�ڶ�����IVA��Ԫ�أ���AΪ̼Ԫ�أ�BΪCO��CΪCO2��DΪH2CO3��̼��Ϊ���ᣬ�������DΪǿ�������һ��Ϣ�����ϣ�B�����
C����AΪ���ۻ��������⣬����Ũ���ᷴӦ������ԭ��Ӧ��C����ȷ��
D����AΪ�������ʣ���D��ҺΪǿ����Һ�����ж�AΪ�ơ�������0. 1 mol/L��NaOH��Һ����ˮ�������c(H+)Ϊ10-13mol/L������ǵ�������D�����ᣬ������0.1mol/L������Һ����ˮ�������������Ũ����10-13mol/L��D����ȷ��
���Դ�ѡ��B�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
A.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=+285.8kJ��mol-1
B.�����ȼ����Ϊ��H=-890kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��l�� ��H=-890kJmol-1
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����ȷ���ʽΪ��N2��g��+3H2��g��![]() 2NH3��g�� ��H=-38.6kJmol-1
2NH3��g�� ��H=-38.6kJmol-1
D.25�桢101kPaʱ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3kJ��mol-1����2H+(aq)+SO![]() (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ��H=-114.6kJ��mol-1
(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ��H=-114.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ư�֢���л�С��������ҩ��X����ʹ�á��Է����廯����AΪ��Ҫԭ�Ϻϳ�X��·�����£�
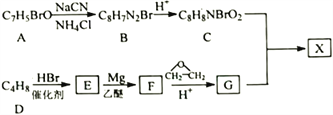
��֪��
�ٺ˴Ź���������ʾA��3�ֻ�ѧ�������⣬Eֻ��1�ֻ�ѧ�������⣻
��![]()
��![]()
�ش��������⣺
��1��A��������______________________��G�����������____________________��
��2��C��һ�������·�Ӧ���ɸ߷��ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ��__________________________��
��3��D����E�ķ�Ӧ����Ϊ_____________________��
��4��X�Ľṹ��ʽΪ_____________________��
��5����֪��ͬһ��̼ԭ��������������OHʱ����ת����![]() ��H��C��ͬ���칹�壬д��������������Ҫ���H�Ľṹ��ʽ______________________��
��H��C��ͬ���칹�壬д��������������Ҫ���H�Ľṹ��ʽ______________________��
�ٱ�����������ȡ������
���ܷ���������Ӧ�����ڼ���������ˮ������ֲ���Ҳ�ܷ���������Ӧ��
��6�����������ϳ�·�ߺ���Ϣ������ϩ�����ѡ���������Ϊԭ��(�������Լ���ѡ)�ϳ�1��6-������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽���������ʣ�������װ��![]() ���ּг�װ������ȥ
���ּг�װ������ȥ![]() ����ʵ�顣����ȡ�����ķ�Ӧԭ����
����ʵ�顣����ȡ�����ķ�Ӧԭ����![]() ��
��

��ʵ��̽����
��1��Aװ��NԪ�صĻ��ϼ���_______�÷�Ӧ�Ƿ���������ԭ��Ӧ��_______��
��2����![]() ����������
����������![]() ��Ӧ�������Ƶñ�״���°��������Ϊ__________L��
��Ӧ�������Ƶñ�״���°��������Ϊ__________L��![]() ��Ħ������Ϊ
��Ħ������Ϊ![]()
��3������ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯����D��ԭ���ǣ�___________________��
��4����ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����![]() ��Ũ���ᣬ�ɹ۲쵽��������___________________��
��Ũ���ᣬ�ɹ۲쵽��������___________________��
��5���������й©����Ӧ��ȡ�ļ��ȴ�ʩ�ǣ�___________________��
��6�����鰱���Ƿ��ռ����ķ�����__________________________________![]()
����չӦ�ã�
��7��ijͬѧ����ͼ��ʾװ�ý��а���������ʵ�飬������ƿ�ڲ�����ɫ��Ȫ������˵����������_______����![]() �����
�����![]() ��
��
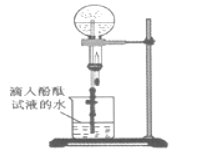
![]() ��ԭ��
��ԭ��![]() ��������ˮ
��������ˮ![]() ��ˮ��Ӧ���ɼ�������
��ˮ��Ӧ���ɼ�������
��8����������;�ܹ㡣����ð�����������������![]() �÷�Ӧ�а�������_______
�÷�Ӧ�а�������_______![]() ������������������ԭ����
������������������ԭ����![]() ��
��
��9�������оٳ�������һ����;_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������õ��Լ�����������Ʒ![]() �г�װ�á�����ʡȥ
�г�װ�á�����ʡȥ![]() �ܹ��ﵽ��Ŀ���ǣ� ��
�ܹ��ﵽ��Ŀ���ǣ� ��
ѡ�� | Ŀ�� | �Լ� | ��������Ʒ |
A | ��֤������������������ | �ữNaCl��Һ��Zn�缫��Fe�缫�����軯�� | �ձ�����ѹ�������ߡ���ͷ�ι� |
B | ���ȷ�Ӧ | ������������ | ��ֽ���ƾ��ơ�ľ����ʢɳ�ӵ������� |
C | ����1.000mol/LNaCl | NaCl | ����ƿ���ձ������������Լ�ƿ |
D | �Ʊ��������� | �Ҵ������ᡢ����̼���� | ��С�Թܡ��ƾ��� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ѳ�Ϊ��ǰ��δ����һ��ȫ�����ش���⣮Ϊ���Ŀǰȼ��ʹ�ù����еĻ�����Ⱦ���⣬��������ԴΣ�����е�ר���������̫���ܴ�ʹȼ��ѭ��ʹ�õĹ��룬��ͼ��ʾ��

����I�������·�Ӧ��ʾ��
��2CO2![]() 2CO+O2
2CO+O2
��2H2O![]() 2H2+O2
2H2+O2
��2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
��2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
��2CO+H2O![]() +3O2
+3O2
��ش��������⣺
��1������I������ת����ʽΪ�� ��ת��Ϊ �ܣ�
��2������ɵڢݸ���Ӧ�Ļ�ѧ����ʽ
��3������ת�������У���H1�͡�H2�Ĺ�ϵ��
��4������1mol��ѧ�����������������
���ۼ� | H��N | H��O | N��N | O=O |
����1mol��ѧ����������/kJmol��1 | 393 | 460 | 941 | 499 |
�����£�N2��H2O��Ӧ����NH3���Ȼ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��̽��ij����M�����ʽ���������ʵ�飬ʵ����̼�������ͼ��ʾ�����ʵ�������жϣ���ͬѧ�ó������н�������ȷ����![]()
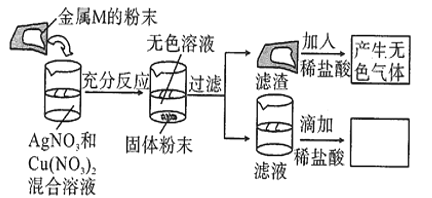
A.����Ľ���M��������
B.����Һ�еμ������ʵ�������Dz�����ɫ����
C.���ַ�Ӧ��δ���˵Ļ�����м���ϡ���ᣬ��������ɫ����һ����![]()
D.������һ�����н���M
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���5L ���ܱ������г���2molX�����1molY���巢����Ӧ��2X(g)+ Y(g) ![]() 2Z(g)����H��0 ��10min ���ƽ�⣬���������ѹǿ�Ƿ�Ӧǰ��5/6������˵������������
2Z(g)����H��0 ��10min ���ƽ�⣬���������ѹǿ�Ƿ�Ӧǰ��5/6������˵������������
A. ƽ��ʱ��X ��ת����Ϊ50��
B. ���¶���ƽ�ⳣ��K=10
C. 10min��������Z �ķ�Ӧ����0.2mol��L-1 ��min-1
D. ijһʱ�̣�X��Y��Z�����ʵ����ֱ���0.4mol��0.2mol��1.6mol���˿�V��<V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƽ�������ʾ�����������в��������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2��FeO������)��ij�������Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�Ce(OH)4��������泥�

��֪��
�����������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��Ce3+��ˮ�⣬Ce4+�н�ǿ�����ԡ�
��CeO2������ϡ���ᡣ
���������[aFe2(SO4)3b(NH4)2SO4cH2O]�㷺����ˮ�ľ���������
(1)���������ڣ��������������ʺ�����������B���� (�����)��
a��NaClO b��H2O2 c��KMnO4
(2)������������� ���������������Һ�к���NH4+�ķ����� ��
(3)д����Ӧ�ڵĻ�ѧ����ʽ ��
(4)�õζ����ⶨ�Ƶõ�Ce(OH)4��Ʒ���ȡ���ȡCe(OH)4��Ʒ���������ܽ����0.1000mol/LFeSO4��Һ�ζ�������FeSO4��Һ�ڿ�����¶��һ��ʱ����ٽ��еζ������ø�Ce(OH)4��Ʒ���������� ��(�ƫ����ƫС������Ӱ�족)
(5)��ȡ14.00g���������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ�ݼ�������NaOH��Һ������ϴ�ӳ�����������������صõ�1.60g���壻����һ����Һ�м���0.5mol/L Ba(NO3)2��Һ100mL��ǡ����ȫ��Ӧ��ͨ�����㣬��������淋Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com