
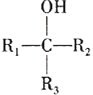
【题目】以芳香烃A和化合物F为原料合成除草剂双苯噁唑酸(I)的一种工艺流程如下:
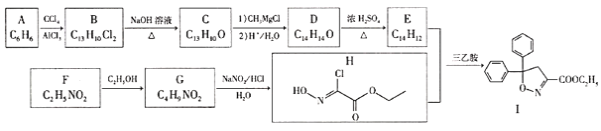
已知以下信息:
①B、C、D、E中均含有两个苯环。
②E能使Br2的CCl4溶液褪色,其核磁共振氢谱有4组峰,峰面积比为2:2:1:1;F中含有两种官能团且具有两性;G能发生水解反应。
③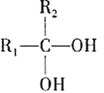 (不稳定)
(不稳定)![]()
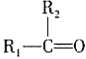
④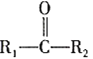
![]()
 ;RCl
;RCl![]() RMgCl
RMgCl
回答下列问题:
(1)F的化学名称为_______。
(2)A生成B、D生成E的反应类型依次为______________、___________________。
(3)E、G的结构简式依次为__________________、________________。
(4)B生成C的化学方程式为_________。
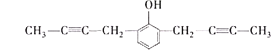
(5)芳香化合物X是D的同分异构体,X的苯环上有3个取代基,能与![]() 溶液发生显色反应,能使
溶液发生显色反应,能使![]() 的
的![]() 溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:______________。
溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:______________。
(6)根据题给信息,写出以乙醛为原料制备2-丁醇的合成路线:________(其他试剂任用)。
【答案】甘氨酸(或α-氨基乙酸或氨基乙酸) 取代反应 消去反应 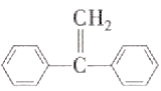
![]()
 、
、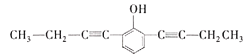 、
、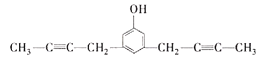 、
、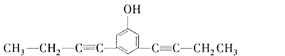 CH3CHO
CH3CHO![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Cl
CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
【解析】
(1)根据信息②,F中含有两种官能团且具有两性,说明含有羧基和氨基,F属于氨基酸,则F的结构简式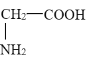 ,该氨基酸的名称为甘氨酸或α-氨基乙酸或氨基乙酸;
,该氨基酸的名称为甘氨酸或α-氨基乙酸或氨基乙酸;
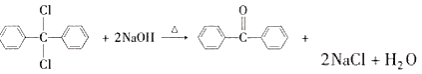
(2)根据信息,B中含有两个苯环,对比A和B分子式,可以看作是两个苯取代CCl4中的两个-Cl,则B的结构简式为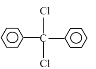 ,该反应为取代反应;D生成E是在浓硫酸作用下分子内脱去1个水分子,该反应为消去反应;
,该反应为取代反应;D生成E是在浓硫酸作用下分子内脱去1个水分子,该反应为消去反应;
(3)E能使Br2的CCl4溶液褪色,说明含有E中碳碳双键,其核磁共振氢谱有4组峰,有4种不同的氢原子,即该结构为对称结构,不同氢原子个数比为2:2:1:1,从而推出E的结构简式为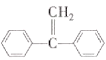 ;G能发生水解,应含有酯基,F为氨基酸,F与C2H5OH发生酯化反应生成G,则G的结构简式为H2NCH2COOC2H5;
;G能发生水解,应含有酯基,F为氨基酸,F与C2H5OH发生酯化反应生成G,则G的结构简式为H2NCH2COOC2H5;
(4)B的结构简式为 ,B在碱性条件下发生水解,两个-OH取代氯原子的位置,然后根据信息③,得出C的结构简式为
,B在碱性条件下发生水解,两个-OH取代氯原子的位置,然后根据信息③,得出C的结构简式为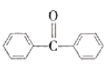 ,则B生成C的反应方程式为
,则B生成C的反应方程式为 +2NaOH
+2NaOH![]()
 +2NaCl+2O;
+2NaCl+2O;
(5) X的分子式为C14H14O,不饱和度为8,其中苯环的不饱和度为4,含有2个碳碳叁键,或4个碳碳双键,核磁共振氢谱有5组峰,说明有5种不同的氢原子,说明是对称结构,能与FeCl3溶液发生显色反应,说明含有酚羟基,能使Br2的CCl4溶液褪色,说明含有碳碳不饱和键,峰面积比为6:4:2:1:1,含有2个甲基,即只能有2个碳碳叁键,则符合题意的结构有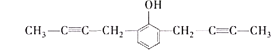 、
、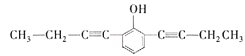 、
、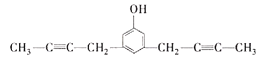 、
、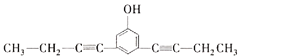 ;
;
(6)用逆推法,2-丁醇可由![]() 与
与![]() 加成后水解得到,
加成后水解得到,![]() 可由氯乙烷与镁反应得到,氯乙烷可由乙醇制备,乙醇可由乙醛与
可由氯乙烷与镁反应得到,氯乙烷可由乙醇制备,乙醇可由乙醛与![]() 加成得到,合成路线为CH3CHO
加成得到,合成路线为CH3CHO![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Cl
CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)乙二胺(![]() )是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与
)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与![]() 、
、![]() 等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“
等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的![]() 的结构式为__________,其中
的结构式为__________,其中![]() 的配位数为__________。
的配位数为__________。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是__________(填序号)。
反应产物的推断正确的是__________(填序号)。
a 不能与![]() 反应
反应
b 含离子键、共价键
c 能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
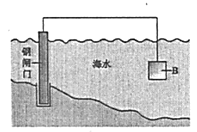
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。

(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:

a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质G可做香料,其结构简式为![]() ,工业合成路线如下:
,工业合成路线如下:

已知:
Ⅰ. 
![]() RCH=CHR'
RCH=CHR'
Ⅱ.RCH2X+NaOH![]() RCH2OH+NaX
RCH2OH+NaX
(R、R'为烃基或H原子,X为卤素原子)
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____(填序号)。
a.密度比水大
b.所有原子均在同一平面上
c.一氯代物只有一种
(2)反应①的反应类型为__________反应。
(3)C的核磁共振氢谱显示有4组峰,步骤②的化学方程式是__________。
(4)③的反应条件是__________。
(5)④为加成反应,E的核磁共振氢谱显示有6组峰,步骤④的化学方程式是_______。
(6)步骤⑤的化学方程式是__________。
(7)下列说法正确的是__________。
a.上述框图中方框内所有物质均为芳香族化合物
b.D存在顺反异构
c.反应②和⑤都是取代反应
(8)反应⑥中Cu是反应的催化剂,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
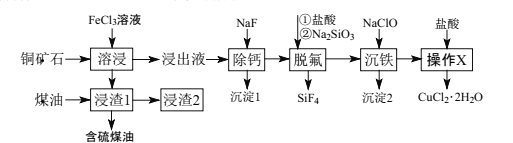
【题目】辉铜矿石主要含有硫化亚铜(Cu2S),还含有FeO、CaO、SiO2等。以辉铜矿石为原料制备CuCl2·2H2O的工艺流程如图所示:
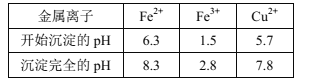
已知:Ⅰ.金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
Ⅱ.NaCl易溶于水,不溶于酒精,随温度变化溶解度变化不明显;CuCl2·H2O易溶于水,酒精,浓氨水,随温度升高溶解度变化明显增大。
Ⅲ.Ksp(CaF2)=4.0×10-11
(1)为了提高“溶浸”效率,可采取的措施是___。写出“溶浸”过程中Cu2S溶解时离子方程式:___。
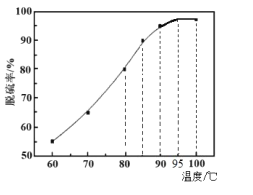
(2)“脱硫”时,随着温度的升高,脱硫率呈上升趋势(如图),原因是___。
(3)写出“脱氟”时HF发生反应的化学方程式:___。
(4)“沉铁”过程中,加入NaClO的两个作用是___。
(5)“操作X”的具体操作是___。
(6)经过“操作X”后,母液经过一系列操作可得到另外一种物质,要得到这种纯净物,最好选用下列试剂洗涤___。
A.浓盐酸 B.水 C.酒精 D.浓氨水
(7)向“浸出液”中加入NaF除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
①ZnSO4+2FeSO4+3Na2C2O4+6H2O![]() ZnFe2(C2O4)3·6H2O↓+3Na2SO4
ZnFe2(C2O4)3·6H2O↓+3Na2SO4
②ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2 ↑+4CO↑+6H2O
ZnFe2O4+2CO2 ↑+4CO↑+6H2O
回答下列问题:
(1)基态 Fe2+的价层电子排布图为___________.
(2)电离能大小比较:I1(Zn)___________ I1(Cu),I2(Zn)___________ I2 (Cu) (填“>”“<”或“=”)。
(3)Na2SO4 中阴离子的空间构型是___________,该离子中 S 的杂化类型是_____。
(4)CO和N2的分子结构相似,标准状况下,VLCO2和CO的混合气体中含键的物质的量为___________。与CO2互为等电子体的离子有____________(写一种即可)。
(5)ZnCl2、ZnBr2、ZnI2 的熔点依次为283℃、394℃、446℃,其主要原因是___________。
(6)铁和碳组成的某种晶体的晶胞如图所示。面心上铁原子相连构成正八面体。
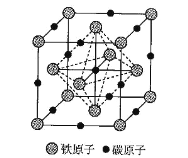
已知该晶体的密度为 dg·cm-3,NA 是阿伏加德罗常数的值。
①该晶体中Fe、C原子的最简比为___________。
②该晶胞中相邻两个面心上铁原子最近的核间距离 D=___________nm(只列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是一类能可逆地吸收和释放氢气的材料。LaNi5合金、NaBH4、H3B-NH3、Mg2NiH4等都是潜在储氢材料。回答下列问题:
(1)基态Ni原子的核外电子排布式为____,有___________个未成对的电子;
(2)NaBH4中H为-1价,Na、B、H电负性由大到小的顺序是_________。BH4-离子的立体构型为________,其中B的杂化轨道类型为_____。
(3)B2H6和NH3化合可以生成H3B-NH3,H3B-NH3加热时发生反应:H3B-NH3=BN+3H2,缓慢释放出H2。BN有类似于石墨的结构,B2H6、NH3和BN的沸点由高到低的顺序为_________, 原因是___。
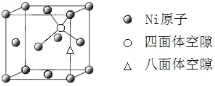
(4)X-射线衍射分析表明,Mg2NiH4 的立方晶胞的面心和顶点均被Ni原子占据,所有Mg原子的Ni配位数都相等。则Mg原子填入由Ni原子形成的_____空隙中(填“四面体”或“八面体”),其空隙占有百分率为_____。
(5)已知Mg2NiH4 晶体的晶胞参数为646.5 pm,液氢的密度为0.0708 g·cm-3。若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则Mg2NiH4 的储氢能力是液氢的___倍(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国药物学家最近合成一种可能用于治疗高血压的有机物K,合成路线如下:
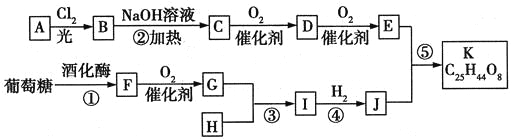
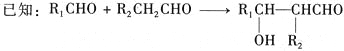
其中A属于碳氢化合物,其中碳的质量分数约为83.3%;E的核磁共振氢谱中只有2组吸收峰。H常温下呈气态,是室内装潢产生的主要污染物之一。G和H以1:3反应生成I。
试回答下列问题:
(1)A的分子式为:______________。
(2)写出下列物质的结构简式:D:____________;G:___________。
(3)反应①―⑤中属于取代反应的有___________。
(4)反应①的化学方程式为_______________;反应④的化学方程式为_________________。
(5)E有多种同分异构体,符合“既能发生银镜反应又能发生水解反应”条件的E的同分异构体有_______种,写出符合上述条件且核磁共振氢谱只有2组吸收峰的E的同分异构体的结构简式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com