
| A. | H3+的电子式为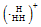 | |
| B. | H3+可进行反应,在液态氢中形成H4+、H6+、H8+ | |
| C. | H3+可在液态氢中形成H5+、H7+、H9+ | |
| D. | H3+广泛存在于固态、液态和气态氢中 |
分析 A、H3+等边三角型,属于二电子三中心离子,带有2个电子,为3个氢原子共用.
B、由信息H3+和氢分子可进一步形成Hn+,可知Hn+中n的值为满足2m+1(m≥1整数).
C、由信息H3+和氢分子可进一步形成Hn+,可知Hn+.中n的值为满足2m+1(m≥1整数).
D、H3+存在于液态氢中.
解答 解:A、H3+等边三角型,属于二电子三中心离子,带有2个电子,为3个氢原子共用,电子式为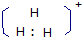 ,故A错误;
,故A错误;
B、由信息H3+和氢分子可进一步形成Hn+,可知Hn+中n的值为满足2m+1(m≥1整数),所以在液态氢中不能形成H4+、H6+,可以形成H9+,故B错误;
C、由信息H3+和氢分子可进一步形成Hn+,可知Hn+中n的值为满足2m+1(m≥1整数),H3+可在液态氢中形成H5+、H7+、H9+,故C正确;
D、H3+存在于液态氢中,在气态、固态中不存在,故D错误.
故选C.
点评 本题是一道信息给予给予题,考查学生根据信息获取知识能力及综合运用能力,题目难度中等,关键是对信息的阅读理解.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应 | B. | 氧化钠和水反应 | ||
| C. | 过氧化钠和水反应 | D. | CO2+H2O+Na2CO3=2NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度(s ) | B. | 物质的量浓度(c ) | C. | 质量分数(w%) | D. | 摩尔质量(M ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 | |
| B. | 0.1 mol•L-1醋酸溶液中:c2(H+)=c(H+)•c(CH3COO-)+KW | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)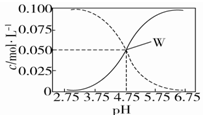 | |
| D. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
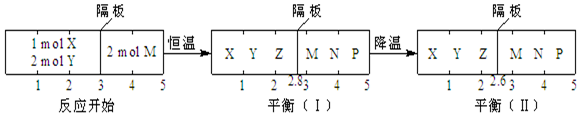
| A. | 反应①的正反应是吸热反应 | |
| B. | 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 | |
| C. | 达平衡(I)时,X的转化率为$\frac{5}{11}$ | |
| D. | 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com