
有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol 电子
D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2+2S2O +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O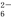 +2H2O。
+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________________,S2O 中S的化合价为________________.
中S的化合价为________________.
(2)反应的化学方程式中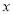 =____________.
=____________.
(3)每生成 1mol Fe3O4,反应转移的电子为_________mol,被Fe2+还原的O2的物质的量为________mol.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列操作不是围绕上述问题的是
A. 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B. 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气
C. 实验室制备CO气体必须在通风橱中进行
D. 蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
A.在同温同压下,相同体积的任何气体单质所含的分子数目一定相同
B.1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒
C.标准状况下,22.4L苯含有的分子数为1NA
D.在常温常压下,11.2 L氮气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:实验题
信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
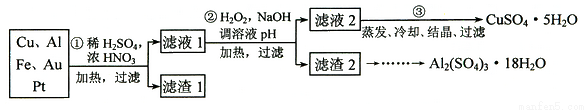
(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O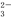 ===2I-+S4O
===2I-+S4O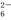 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。

下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
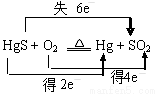
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
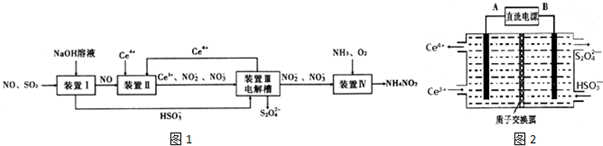
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com