
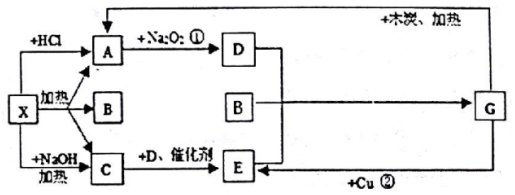
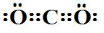 ;G的化学式为HNO3.
;G的化学式为HNO3.分析 X为正盐,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠反应,则A为CO2,则X应为(NH4)2CO3,B为H2O;结合转化关系可知,A与过氧化钠反应生成D,则D为O2;C(NH3)与D(O2)催化氧化生成气体E,则E为NO;G与木炭加热生成二氧化碳、与Cu反应生成NO,则G为HNO3,据此结合物质的性质进行解答.
解答 解:X为正盐,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3;气体A能与过氧化钠反应,则A为CO2,则X应为(NH4)2CO3,B为H2O;结合转化关系可知,A与过氧化钠反应生成D,则D为O2;C(NH3)与D(O2)催化氧化生成气体E,则E为NO;G与木炭加热生成二氧化碳、与Cu反应生成NO,则G为HNO3,
(1)根据分析可知,X为(NH4)2CO3,碳酸铵中含有的化学键为离子键和共价键;A为CO2,二氧化碳为共价化合物,分子中含有两个碳氧双键,其在为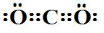 ;G为HNO3,
;G为HNO3,
故答案为:(NH4)2CO3;离子键、共价键;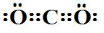 ;HNO3;
;HNO3;
(2)反应①为过氧化钠与水的反应,飞跃的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)反应②为铜与稀硝酸的反应,该反应的离子方程式为:Cu+4H++2NO3_═Cu2++2NO2↑+4H2O,
故答案为:Cu+4H++2NO3_═Cu2++2NO2↑+4H2O;
(4)过量的Fe粉与G(HNO3)的稀溶液反应生成硝酸亚铁、NO和水,向反应后溶液中加入碱溶液,反应生成氢氧化亚铁,氢氧化亚铁不稳定,迅速被氧化,最终变为红褐色的氢氧化铁,所以反应现象为:先产生白色沉淀,随后变为灰绿色,最后生成红褐色沉淀;反应的离子方程式为:Fe2++2OH_═Fe(OH)2、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:先产生白色沉淀,随后变为灰绿色,最后生成红褐色沉淀;Fe2++2OH_═Fe(OH)2;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查无机物的推断,注意元素化合物的性质应用,题目难度较大,本题解答时要善于抓住题中信息,为解答该题的关键,也是易错点,学习中要加强信息迁移能力的培养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
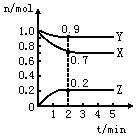 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$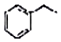
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$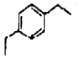
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$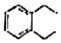
 .
.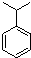 ,N:
,N: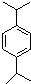 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Na+、K+、OH-、Cl- | ||
| C. | Mg2+、Na+、OH-、SO${\;}_{4}^{2-}$ | D. | Ba2+、H+、CO${\;}_{3}^{2-}$、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com