
| A、CH3CH2OH |
B、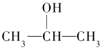 |
| C、CH3OH |
| D、CH3CH2COOH |


科目:高中化学 来源: 题型:
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔(C2H2)和甲苯(C7H8) |
| B、乙醇(CH3CH2OH)和丙醇(CH3CH2CH2OH) |
| C、乙醇(CH3CH2OH)和乙醚(C2H5OC2H5) |
| D、甲醛( HCHO)和乙酸(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、少量CO2通入Ca(ClO)2溶液生成CaCO3,则少量SO2通入Ca(ClO)2溶液生成CaSO3 |
| C、硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 |
| D、镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH≡C-CH3 |
B、 |
| C、CH2=CHCH3 |
D、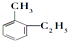 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A>B>D>C |
| B、原子序数:d>c>b>a |
| C、离子半径:C>D>B>A |
| D、元素的第一电离能:A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com