
| A、中和热的测定(量筒、温度计、酒精灯) |
| B、从溴水中提取溴单质(分液漏斗、无水乙醇、玻璃棒) |
| C、探究浓硫酸与铜反应的产物(蘸有碳酸钠溶液的棉花团、蒸馏水、烧杯) |
| D、制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
A、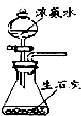 可制取氨气 |
B、 可分离CH3CH2OH和CH3COOC2H5混合液 |
C、 可制备Fe(OH)2并容易观察到白色沉淀 |
D、 可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维遇强碱会“断路” |
| B、从海带中提取碘的过程涉及氧化还原反应 |
| C、钠可把钛、锆、铌、钽等金属从其熔融卤化物里还原出来 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、使用此装置可减少导致酸雨的气体形成 |
| B、装置内发生了化合反应和分解反应 |
| C、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 |
| D、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
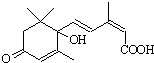 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A、其分子中含有2个手性碳原子 |
| B、既能发生加聚反应,又能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 比较Na2CO3与NaHCO3的稳定性 |
B、 吸收NH3,并防止倒吸 |
C、 蒸干AlCl3饱和溶液制备AlCl3晶体 |
D、 制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com