
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是| A.Ksp·Kh=Kw3 | B.Ksp·Kw=Kh |
| C.Kh/Kw=Ksp | D.Kw/Kh=Ksp3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。| 物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 | 9.6 |
| 完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl沉淀生成和溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl的溶解度减小 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
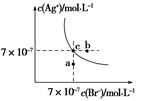
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com