
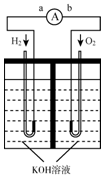
 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:分析 (1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极;
(2)碱性条件下,氢气失电子和氢氧根离子反应生成水;
(3)反应物接触面积越大,其反应速率越快;
(4)①反应值失电子的物质是还原剂,得电子的物质是氧化剂;
②根据氢气体积计算LiH的质量,再根据V=$\frac{m}{ρ}$计算LiH的体积;
③根据氢气中转移电子之间的关系式计算
解答 解:(1)通入燃料的电极是负极、通入氧化剂的电极是正极,所以通入氢气的电极是负极,通入氧气的电极是正极,电子从负极沿导线流向正极,则电子流向由a到b,
故答案为:由a到b;
(2)碱性条件下,氢气失电子和氢氧根离子反应生成水,电极反应式为:H2+2OH--2e-=2H2O,
故答案为:H2+2OH--2e-=2H2O;
(3)反应物接触面积越大,其反应速率越快,在电极表面镀铂粉,增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本,故答案为:增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本;
(4)①2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH反应中Li失电子作还原剂,反应II中H2O得电子作氧化剂;
故答案为:Li;H2O;
②根据2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH得生成LiH的质量=$\frac{224L}{22.4L/mol}$×2×8g/mol=160g,LiH的体积=$\frac{160g}{0.8g/c{m}^{3}}$=200cm3,氢气体积=224L=224000cm3,所以生成的LiH体积与被吸收的H2体积比=200cm3:224000cm3=$\frac{1}{1120}$;
故答案为:$\frac{1}{1120}$;
③由2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH、LiH+H2O=LiOH+H2↑得若能量转化率为80%,则转化的氢气物质的量=$\frac{224L×80%}{22.4L/mol}$=8mol,最终生成氢气的物质的量是16mol氢气,则转移电子的物质的量=16mol×2=32mol,
故答案为:32mol.
点评 本题考查了原电池原理、氧化还原反应,涉及电极反应式的书写、电子流向的判断等知识点,根据得失电子确定正负极,再结合正负极上发生的反应来分析解答,题目综合性较强,难度中等,侧重于考查学生的分析能力和计算能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
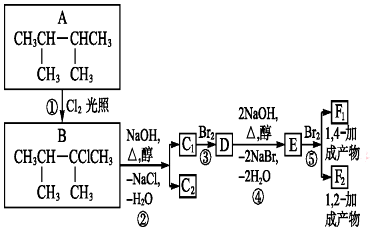
 .
. ;F1的结构简式是
;F1的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | 1摩尔任何物质所含的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎碰倒酒精灯,洒出酒精在桌上燃烧,应立即用湿抹布扑盖 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 实验后,剩余的药品不能放回原瓶,也不能随便丢弃 | |
| D. | 不慎把浓碱溅在皮肤上,用大量水冲洗后,再涂上碳酸氢钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com