
【题目】(1)若1.92 g Cu粉与一定量浓HNO3反应,当Cu完全反应时,收集到标准状况下1.12L气体,则消耗硝酸________mol,生成NO2________mol;
(2)若向Cu中加入硫酸和硝酸的混酸溶液制取CuSO4溶液,则混酸中硫酸与硝酸的最佳物质的量之比为__________。
【答案】0.11 0.045 3∶2
【解析】
(1) 参加反应的HNO3包括被还原的HNO3和起酸性作用的HNO3,根据氮元素守恒计算消耗硝酸的物质的量;根据得失电子守恒计算生成NO2的物质的量;
(2) Cu、H+、NO3—按3Cu+8H++2NO3—=3Cu2++2NO+4H2O恰好完全反应时混酸中H2SO4和HNO3的比例最佳。
(1)参加反应的HNO3包括被还原的HNO3和起酸性作用的HNO3,根据氮元素守恒,表现酸性的HNO3为![]() ×2=0.06 mol,被还原的HNO3为
×2=0.06 mol,被还原的HNO3为![]() =0.05mol,故参加反应的HNO3为0.05mol+0.06 mol=0.11mol。
=0.05mol,故参加反应的HNO3为0.05mol+0.06 mol=0.11mol。
设标准状况下1.12 L气体中,含NOxmol、NO2ymol
则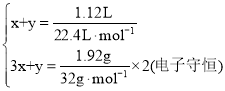
解之得![]() ,生成NO2 0.045mol。
,生成NO2 0.045mol。
(2)设H2SO4与HNO3的物质的量分别为x、y,根据方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O知![]() =4,x∶y=3∶2。
=4,x∶y=3∶2。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学平衡的判断正确的是( )
A.化学平衡向正反应方向移动,反应物的转化率不一定增大
B.对于放热反应,降低温度将缩短反应达到平衡的时间
C.对于有气体参加的反应,改变反应体系的压强,化学平衡一定移动
D.同一可逆反应,在温度![]() 时,反应对应的平衡常数
时,反应对应的平衡常数![]() ,则说明该反应为放热反应
,则说明该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述和解释均正确且有对应关系的是( )
选项 | 描述 | 解释 |
A | 84消毒液可以消灭新型冠状病毒 |
|
B | 用灼烧法鉴别纤维素和聚乙烯塑料 | 纤维素有烧焦羽毛的气味 |
C | 《易经》载有“泽中有火”上火下泽” | 燃烧的气体可能为水煤气 |
D | 《四川盐法志》记载;当煮盐近于饱和时,往卤水中点加豆汁,至渣滓皆浮聚于面 | 加豆汁除渣利用了胶粒的吸附作用 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素形成的单质和化合物在化工、材料、医学等领域应用广泛,回答下列问题:
(1)区分金刚石和无定形碳最可靠的科学方法为___________。基态C原子核外未成对电子的数目为_____________。
(2)咖啡因结构为 。
。
①咖啡因中C原子的杂化形式为_________________。
②1 mol咖啡因中所含![]() 键数目为_________________。
键数目为_________________。
③咖啡因通常在水中的溶解度较小,加入适量![]() 能增大其在水中溶解度的原因为_________________。
能增大其在水中溶解度的原因为_________________。
④CH3+(甲基正离子)的立体构型为_________________。
(3)CO、NO、H2S均为生命体系气体信号分子。其中H、C、O、S的电负性由大到小的顺序为____________;N、O、S的第一电离能由大到小的顺序为________________。
(4)干冰可用于人工降雨。其熔点低于金刚石的原因为___________;若干冰的密度为1.56 g/cm3,立方晶胞参数为0.57 nm,则每个晶胞实际占用CO2的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是制取海绵钛和氯化法钛白(二氧化钛)的主要原料,用于制造颜料和钛有机化合物以及国防上用的烟幕剂。同时也是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3,含有少量Fe2O3、SiO2、Al2O3等杂质),制备TiCl4等产品的一种工艺流程如下:

已知:
Ⅰ.①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe===3Fe2+、2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O、Ti3+(紫色)+ Fe3++ H2O===2TiO2+(无色)+ Fe2++2H+;
Ⅱ.四氯化钛的熔点-25.0℃,沸点136.4℃,SiCl4的熔点-68.8℃,沸点57.6℃。
回答下列问题:
(1)用盐酸酸浸时,为使酸浸速率加快,可采取的措施是:________________(至少写2条),发生主要反应的离子方程式为:___________。
(2)废渣的成分是_______。
(3)如何检验富含TiO2+溶液中是否还含铁元素_____________。
(4)若将制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应![]() 的平衡常数K=____。
的平衡常数K=____。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_______(只要求写出一项)。
(6)要精制含少量SiCl4杂质的TiCl4,可采用的方法是_______。
(7)用TiCl4水解生成TiO2·nH2O,经过滤、水洗除去其中的Clˉ,再烘干、焙烧除去水分得到粉体TiO2.写出TiCl4水解生成TiO2·nH2O的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )

A. 二氧化硫和浓硫酸
B. 二氧化硫和碳酸氢钠溶液
C. 氯气和氢氧化钠溶液
D. 二氧化碳和氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。

下列说法不正确的是
A.此温度下该反应的化学方程式为2A(g)+B(s)![]() 3C(g)
3C(g)
B.t4-t5阶段改变的条件为减小压强
C.B的起始物质的量为1.0 mol
D.在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+2c/3=2.4和b+c/3=1.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
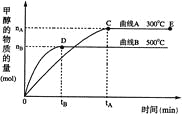
A. 反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B. 升高温度,K值增大
C. 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB/2nBmol·(L·min)-1
D. 其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com