
分析 分子的立体构型是指分子中的原子在空间的排布,有两种情况:一种不包括中心原子未成键的孤对电子;另一种包括中心原子未成键的孤对电子,价层电子对互斥模型:分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;根据价电子对互斥理论确定原子的杂化方式和分子的空间构型,价层电子对个数=σ键个数+孤电子对个数;BF3分子中硼原子杂化轨道数为3,所以采取sp2杂化;分子的空间构型为平面三角形,NF3中N杂化轨道数为4,孤对电子数为$\frac{5-3×1}{2}$=1,则为sp3杂化,为三角锥形,据此分析解答.
解答 解:价层电子对互斥模型:分子空间构型有两种:一种是考虑中心原子上的价电子都用于形成共价键,另一种是考虑中心原子上有孤对电子,
根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.
BF3分子中中心原子B原子和F原子形成3个σ键,孤电子对个数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(3-1×3)=0,不含孤电子对,所以其价层电子对个数是3,则杂化类型是sp2,B原子的3个价电子都与F原子形成共价键,立体构型是平面三角形,
NF3分子中N原子和F原子形成3个σ键,孤电子对个数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(5-1×3)=1,含有一个孤电子对,N原子杂化方式为sp3,由于一对孤对电子的存在,三个F不可能平分N周围的空间,而是被孤对电子排斥到一侧,形成三角锥形结构,
故答案为:中心原子上的价电子都用于形成共价键;中心原子上有孤对电子;B;N;BF3分子中B原子的3个价电子都与F原子形成共价键,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对为成键的电子对,占据了N原子周围的空间,参与相互排斥,形成三角锥形.
点评 本题考查了微粒空间构型的判断,明确价层电子对互斥理论是解本题关键,注意分子的立体构型与价层电子对互斥模型的区别,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 100mL0.1mol•L-1醋酸溶液含有的分子总数一定小于0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.05mol/L | D. | 0.50mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和CO2反应 | B. | Cu(OH)2溶液和稀H2SO4反应 | ||
| C. | 氢氧化钡溶液和硝酸反应 | D. | 氨水和稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
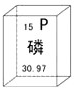
| A. | 磷元素为非金属元素 | B. | 磷原子核外有15个电子 | ||
| C. | 磷的原子序数为15 | D. | 相对原子质量为30.97g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 236 kJ•mol-1 | B. | -116 kJ•mol-1 | C. | -236 kJ•mol-1 | D. | 116 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com