
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA | |
| B. | 0.1 mol/L (NH4)2SO4溶液与0.2 mol/L NH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
分析 A.每个NO2和CO2分子均含有2个O原子,故二者混合气体中含有O原子数目为分子总数的2倍;
B.溶液体积未知;
C.求出混合物的物质的量,然后根据1mol氢气和1molCO燃烧时均消耗0.5mol氧气来分析;
D.钠与氧气反应无论生成氧化钠还是过氧化钠,1个钠原子都失去1个电子生成1个钠离子;
解答 解:A.每个NO2和CO2分子均含有2个O原子,故分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA,故A正确;
B.依据n=CV,溶液体积未知,无法比较氨根离子数目,故B错误;
C.标况下8.96L混合物的物质的量为0.4mol,而1mol氢气和1molCO燃烧时均消耗0.5mol氧气,故0.4mol混合气体燃烧消耗0.2mol氧气,与两者的比例无关,故C正确;
D.钠与氧气反应无论生成氧化钠还是过氧化钠,1个钠原子都失去1个电子生成1个钠离子,则1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,生成1mol钠离子,钠失去NA个电子,故D正确;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常,同周期元素的第一电离能ⅦA族的元素最大 | |
| B. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| C. | 第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 | |
| D. | 主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的甲醇所含的氢原子数等于2NA | |
| B. | 常温常压下,Na2O2 与 H2O 反应生成 1mol O2 时,转移电子数是 2NA | |
| C. | 25℃时,Kap(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-6 NA | |
| D. | 1L 1 mol/L AlCl3溶液中含有的Al3+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的核心是应用化学原理对环境污染进行治理 | |
| B. | “火树银花”中的焰火实质上是金属元素的焰色反应 | |
| C. | 李白有诗云“日照香炉生紫烟”这是描写“碘的升华” | |
| D. | 煤经过气化、液化和干馏等物理变化过程,可以转化为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
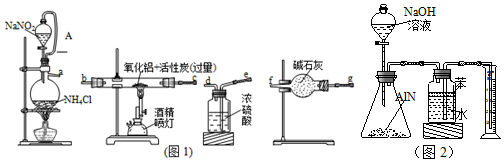
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
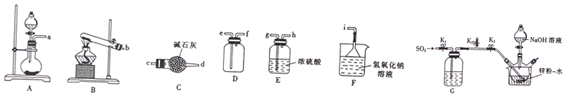
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com