
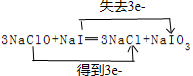 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3. 分析 (1)光导纤维原料为二氧化硅;
(2)电解质是指溶于水溶液中或在熔融状态下就能够导电化合物,非电解质是溶于水溶液中和在熔融状态下都不能够导电化合物,单质、混合物既不是电解质,也不是非电解质;
(3)物质所含元素化合价升高的反应物为还原剂,所含元素化合价降低的为氧化剂,分析反应中元素化合价变化,判断转移电子数目及还原剂与氧化剂的物质的量之比.
解答 解:(1)光导纤维原料为二氧化硅,化学式为:SiO2;
故答案为:SiO2;
(2):①铜是单质,既不是电解质,也不是非电解质;
②蔗糖溶于水溶液中和在熔融状态下都不能够导电化合物,是非电解质;
③熔化的KNO3溶于水溶液中或在熔融状态下就能够导电化合物,是电解质;
④BaSO4熔融状态下就能够导电化合物,是电解质;
⑤氯化镁溶液,是混合物,既不是电解质,也不是非电解质;
属于电解质的是③④,属于非电解质的是②;
故答案为:③④;②;
(3)3NaClO+NaI═3NaCl+NaIO3,反应中次氯酸钠+1价氯化合价降为氯化钠中-1价,次氯酸钠为氧化剂,碘化钠中-1价碘化合价升高为碘酸钠中+5价碘,碘化钠为还原剂,3mol次氯酸钠反应得到3mol电子,用双线桥表示为: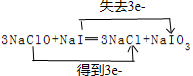 ;
;
还原剂与氧化剂物质的量之比为:1:3;
故答案为: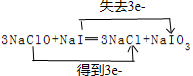 ;1:3.
;1:3.
点评 本题为综合题,考查了电解质、非电解质判断,氧化还原反应分析,题目难度不大,掌握基础是解题关键,注意氧化还原反应得失电子守恒规律.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯生中含有氧气分子 | |
| B. | 三氯生由碳、氢、氯、氧四种元素组成 | |
| C. | 三氯生是一种有机物 | |
| D. | 一个三氯生分子共含有24个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中钾离子浓度为2 mol/L | |
| B. | 上述电解过程中共转移6摩尔电子 | |
| C. | 电解得到的铜的物质的量为0.5摩尔 | |
| D. | 电解后溶液中的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
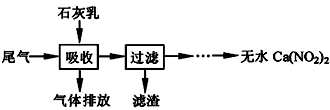
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
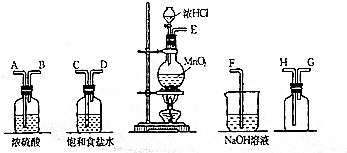
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com