
【题目】异丙苯( )氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:

已知:

完成下列填空:
(1).X物质是 ;Y物质是 。
(2).浓硫酸的作用是 ,其优点是用量少,可能的缺点是 (写一条)。
(3).Z物质最适宜选择 (选填编号)。
a.NaOH b.Na2CO3c.NaHCO3d.CaCO3
(4).步骤⑥分馏,工业上在分馏塔中进行,如右图,产品T是 ,请说明理由 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:

①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
(5).已知:BrO3–+5Br–+6H+→3Br2 + 3H2O ;写出苯酚与浓溴水反应的化学方程式 ;
第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 。
(6).已知:I2+ 2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是 ;该废水中苯酚的浓度是 mol/L(保留4位小数)。
【答案】(1).氧气(或空气);异丙苯
(2).催化剂(1分),浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等),合理即得分) (3).c
(4).丙酮(1分) 丙酮的沸点低
(5).![]() ,防止溴挥发
,防止溴挥发
(6).由蓝色变为无色(或白色浑浊)且半分钟内不变色 0.0053
【解析】试题(1).在反应器A发生信息中的反应①,故需要氧气或空气,Y为未反应的异丙苯,循环利用。
(2). 在浓硫酸作条件下分解得到
在浓硫酸作条件下分解得到![]() 、
、![]() ,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备;
,浓硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备;
(3).加入Z的目的是中和硫酸,且不能与苯酚反应,a.NaOH能与硫酸、苯酚反应,故不选;b.CaCO3为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故b不选;c.NaHCO3能与硫酸反应,不与苯酚反应,故c选;d.CaO能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反应,故d不选;故选c;(4).由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则T为丙酮;理由为丙酮的沸点低于苯酚;(5).写出苯酚与浓溴水反应的化学方程式![]() ;溴易挥发,可防挥发;(6).滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色; 20mLKBrO3和KBr混合溶液c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L在盐酸酸化的条件下可生成Br2的物质的量为0.0100mol/L×0.02L×3=0.0006mol,根据I2+ 2Na2S2O3→2NaI + Na2S4O6反应可Br2氧化KI得到的I2的物质的量为0.0250 mol/L×0.02248L×1/2=0.000281mol,结合Br2+2I-=I2+2Br-,可知与苯酚反应的Br2的物质的量为0.0006mol-0.000281mol=0.000319mol,可知苯酚的物质的量为0.000319mol×1/3=0.000106mol,则苯酚的浓度为0.000106mol÷0.020L=0.0053mol/L。
;溴易挥发,可防挥发;(6).滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色; 20mLKBrO3和KBr混合溶液c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L在盐酸酸化的条件下可生成Br2的物质的量为0.0100mol/L×0.02L×3=0.0006mol,根据I2+ 2Na2S2O3→2NaI + Na2S4O6反应可Br2氧化KI得到的I2的物质的量为0.0250 mol/L×0.02248L×1/2=0.000281mol,结合Br2+2I-=I2+2Br-,可知与苯酚反应的Br2的物质的量为0.0006mol-0.000281mol=0.000319mol,可知苯酚的物质的量为0.000319mol×1/3=0.000106mol,则苯酚的浓度为0.000106mol÷0.020L=0.0053mol/L。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
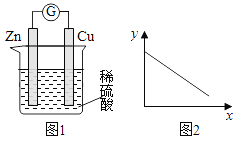
A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据A-K在周期表中的位置(如图),回答下列问题:
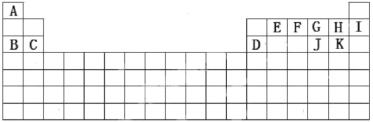
(1)最外层电子数是次外层电子数2倍的元素在周期表中的位置______________,化学性质最不活泼的元素是____________________(填化学符号或者化学式,下同)。
(2)E元素最高价氧化物的电子式____________________。
(3)D的最高价氧化物与K的最高价氧化物对应的水化物反应的离子方程式为_______________。
(4)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为____________。
(5)C、D、G、H、J离子半径由大到小的顺序是___________________。
(6)用电子式表示化合物![]() 的形成过程:_________________________。
的形成过程:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)B中所含官能团名称是____________。
(2)上述分子中属于C的同系物的是__________(填序号)。
(3)等物质的量的上述烃,完全燃烧时消耗O2最多的是_______,等质量的上述烃完全燃烧时消耗O2最多的是_________(填序号)。
(4)E的分子式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A.Zn为电池的负极,发生氧化反应
B.电池工作时OH-向负极迁移
C.该电池放电过程中电解质溶液浓度增大
D.正极反应式为:2FeO42-+10H++6e-=Fe2O3+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料。结合以下合成路线,回答下列问题。

(1)乙烯的结构简式是______,A(乙醇)所含官能团的名称是__________。
(2)制备F(CH3-CH2Cl)有以下两种方案:
方案一 乙烷和氯气的取代反应 ;方案二 乙烯和氯化氢的加成反应
方案二优于方案一的原因是:_____________________________________ 。
(3)以乙烯为原料合成有机高分子化合物D(聚乙烯)的化学方程式为: 。
(4)以乙烯为原料可以合成一种有香味的物质E,实验室可通过下图所示装置来实现,请写出以下变化的化学方程式:

已知:B转化为C的化学方程式为:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
① A→B的化学方程: 。
② A+C→E的化学方程式: 。
(5)装置中导管末端不能插入饱和碳酸钠溶液中,是为了 。
(6)试管中饱和碳酸钠溶液的作用为:
(7)饱和碳酸钠溶液的试管中可看到的实验现象为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A,其蒸汽对氢气的相对密度是42,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ,名称为____________________。
(2)A中的碳原子是否都处于同一平面?___________(填“是”或“不是”);
(3)已知A、B、C有如下转化关系:
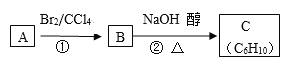
则反应②的化学方程式为 ;反应的类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,9.5 g羟基(![]() )含有的中子数为
)含有的中子数为![]()
B.![]() 中含有的
中含有的![]() 键数量为
键数量为![]()
C.![]() 与足量浓盐酸反应产生
与足量浓盐酸反应产生![]() 时转移电子数为
时转移电子数为![]()
D.![]() 溶液中含有的阴离子总数大于
溶液中含有的阴离子总数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是重要的医药中间体,B中碳原子数目是A中的3倍。以A和B为原料合成该有机物的路线如下:

(1)已知A+B→C为加成反应,则A的结构简式为___________,B的化学名称为 _______,E中含有的官能团有_______________________(填名称)。
(2)1mol C在一定条件下与浓溴水反应,最多消耗溴的物质的量为______mol。C生成D的反应类型为______________。
(3)2分子C脱水可以生成F,核磁共振氢谱显示F分子中含有4种氢原子,其结构中有3个六元环,则F分子的结构简式为________________。
(4)E有多种同分异构体,其中苯环上只有2个对位取代基,含有-COOH且能使FeCl3溶液显紫色的结构有_______________(不考虑立体异构)种。
(5)根据已有知识并结合信息  ,写出以CH3COOH为原料制备A的合成路线图:___________________________________。(无机试剂任选,注明反应条件)。
,写出以CH3COOH为原料制备A的合成路线图:___________________________________。(无机试剂任选,注明反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com