
某课外活动小组的同学从某地颗粒采集器中获得雾霾颗粒样品,然后用蒸馏水浸取。在探究雾霾颗粒可溶性成分的实验中,下列根据实验现象得出的结论不正确的是
A.向浸取液中滴入AgNO3溶液有白色沉淀产生,说明雾霾中一定含有Cl-
B.向浸取液中滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42-
C.向浸取液中加入Cu和浓H2SO4,试管口有红棕色气体产生,说明雾霾中可能含有NO3-
D.向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有NH4+
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl-
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(15分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ?H =a kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H =b kJ/mol (II)
2ClNO(g) K2 ?H =b kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),?H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10 12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:计算题
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:

已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是 。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是 。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是 。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升 水样相当于消耗多少毫克O2表示,单位:mg?L-1)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。下列有关H2S的说法正确的是
A.H2S属于非电解质 B.人体内H2S可由含硫蛋白质降解产生
C.大量吸入H2S对人体无害 D.H2S只有还原性没有氧化性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.1mol Cl2与足量NaOH溶液反应,转移电子的数目为0.2NA
B.0.1mol苯乙烯中含有碳碳双键的数目为0.4NA
C.标准状况下,11.2L乙醇中含有羟基的数目为0.5NA
D.4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:计算题
(17分)工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g)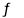 CO(NH2)2(g)+ H2O(g) △H1 = -536.1 kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 = -536.1 kJ·mol-1
(1)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
A.通入氦气 B.缩小体积
C.加入催化剂 D.除去体系中的水蒸气
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 = -1806.4 kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式 。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题:

(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是 (填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com