
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等.化学在解决雾霾污染中有着重要的作用.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol ﹣12NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)△H=kJmol﹣1 .
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= .
(2)如图1是一种用NH3脱除烟气中NO的原理. 
①该脱硝原理中,NO最终转化为H2O和(填化学式).
②当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为L.
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示,写出NO分解的化学方程式: .
【答案】
(1)﹣41.8;1.8
(2)N2;11.2
(3)3NO ![]() N2O+NO2
N2O+NO2
【解析】解:(1)2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1① 2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1 ②
将方程式 ![]() 得:NO2(g)+SO2(g)SO3(g)+NO(g)△H=
得:NO2(g)+SO2(g)SO3(g)+NO(g)△H= ![]() =﹣41.8kJ/mol,
=﹣41.8kJ/mol,
NO2(g)+ | SO2(g) | SO3(g)+ | NO(g) | |
起始物质的体积 | a | 2a | 0 | 0 |
转化物质的体积 | x | x | x | x |
平衡物质的体积 | a-x | 2a-x | x | x |
平衡时NO2与SO2体积比为1:5,即(a﹣x):(2a﹣x)=1:5,故x= ![]() a,故平衡常数K=
a,故平衡常数K= ![]() =
= ![]() =
= ![]() =1.8,
=1.8,
所以答案是:﹣41.8;1.8;(2)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O,
所以答案是:N2;②反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,1molNH3转化为N2失去3mol电子,0.5molO2得到2mol电子,则NO转化为N2得到的电子为1mol,所以NO的物质的量为0.5mol,其体积为22.4L/mol×0.5mol=11.2L,
所以答案是:11.2;(3)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5 , 由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2 , 所以方程式为3NO ![]() N2O+NO2 ,
N2O+NO2 ,
所以答案是:3NO ![]() N2O+NO2 .
N2O+NO2 .
【考点精析】掌握反应热和焓变和化学平衡的计算是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某种制取纯碱的方法如下:

(1)写出“反应I ”的化学方程式:__。
(2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。

(3)写出“煅烧”反应的化学方程式:__。
(4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。
(5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。
【答案】 NH3·H2O+CO2=NH4HCO3 NaCl+NH4HCO3=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O 2NH4Cl+Ca(OH)2
Na2CO3+CO2↑+H2O 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+
CaCl2+2NH3↑+2H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】(1)氨水显碱性,CO2为酸性氧化物,二者反应生成盐,CO2过量时生成酸式盐即碳酸氢铵,故化学方程式为:NH3·H2O+CO2=NH4HCO3。
(2)氨气极易溶于水,氨水的浓度非常大,可以溶解大量的氨气,则反应I得到浓度较大的碳酸氢铵溶液。向碳酸氢铵溶液中加入食盐后,溶液中主要存在四种离子:Na+、NH4+、HCO3-、Cl-,根据溶解度曲线可知,同温度下NaHCO3的溶解度最小,溶液中会析出晶体NaHCO3。反应II为复分解反应,则反应方程式为NaCl+NH4HCO3=NaHCO3↓+NH4Cl。
(3)过滤得到NaHCO3晶体,加热,NaHCO3分解为Na2CO3、H2O、CO2,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)向NH4Cl溶液中加入石灰乳,NH4+与OH-结合为NH3·H2O,加热条件下,促进NH3逸出,即为“蒸氨”,反应方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(5)氨气溶于水得NH3·H2O,NH3·H2O碱性强于Al(OH)3,故将NH3通入Al2(SO4)3溶液中有Al(OH)3沉淀生成,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
【题型】综合题
【结束】
22
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素B2也称“核黄素”,其结构如下图.维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病.下列有关维生素B2的说法中正确的是( ) 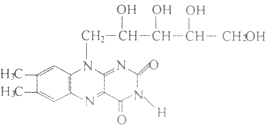
A.核黄素晶体属于离子晶体
B.核黄素能发生银镜反应
C.核黄素能被酸性高锰酸钾溶液氧化
D.核黄素能与氯化铁溶液作用呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离平衡常数 | 1.8×10﹣5 | Ka1=5.4×10﹣2 | Ka1=1.3×10﹣7 |
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序
(3)H2C2O4与少量的KOH溶液反应的化学方程式:
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号). ①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a表示放热反应X(g)+Y(g)Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( ) 
A.减压
B.加大X的投入量
C.升高温度
D.减小体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为结晶牛胰岛素分子结构示意图。已知胰岛素含有A、B两条多肽链,A链含有21个氨基酸,B链含有30个氨基酸,两条多肽链间通过两个二硫键(二硫键由两个—SH脱掉两个氢连接而成)连接,在A链上也形成1个二硫键。则胰岛素分子中含有的肽键数和51个氨基酸脱水缩合形成胰岛素后,相对分子质量比原来减少的数值各是( )
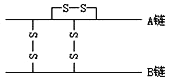
A. 49 882 B. 49 888 C. 50 882 D. 50 888
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法错误的是( )
A.除去乙炔中混有的H2S气体通过盛有氢氧化钠溶液的洗气瓶
B.除去甲烷中混有的乙烯通过盛酸性高锰酸钾溶液的洗气瓶
C.除去酒精中的水加入足量生石灰后进行蒸馏
D.除去苯中混有的苯酚加入足量氢氧化钠溶液后进行分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com