
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子分子中 | |
| D. | 含有共价键的化合物都是共价键化合物 |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入石蕊试液后,呈蓝色 | |
| B. | 向溶液中加入酚酞试液后,呈红色 | |
| C. | 将溶液在试管中加热至沸腾,试管口放置的红色石蕊试纸变蓝色 | |
| D. | 将溶液中加入过量烧碱溶液加热至沸腾,试管口放置的红色石蕊试纸变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染 | |
| B. | 可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的 | |
| C. | 由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸 | |
| D. | 事故发生地周围比较空旷,有人提议用点火焚烧的办法来清除泄漏物,会产生大量浓烟,所以该方法未被采纳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
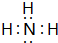 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
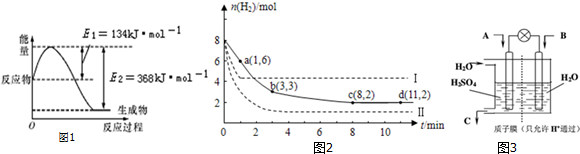
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com