
【题目】等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图甲,则曲线a、b、c、d所对应的试验组别是( )
组别 | c(HCl)(mol·L-1) | 温度(℃) | 铁的状态 |
|
1 | 2.0 | 25 | 块状 | |
2 | 2.5 | 30 | 块状 | |
3 | 2.5 | 50 | 粉末状 | |
4 | 2.5 | 30 | 粉末状 |
A.3-4-2-1B.1-2-4-3C.4-3-2-1D.1-2-3-4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数值,下列叙述中正确的
A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
B.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2溶液中阳离子总数小于0.2NA
D.5.6 g铁在足量的O2中燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
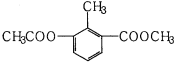
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_________(只要求写表达式,不需计算)mol·L-1。
(3)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有______。(填化学符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2HClO+Mg=Mg(ClO)2++H2↑。下列表示反应中相关微粒的化学用语正确的是
A.中子数为20的氯原子:![]() ClB.次氯酸的电离方程式:HClO=H++ClO-
ClB.次氯酸的电离方程式:HClO=H++ClO-
C.次氯酸的电子式:![]() D.镁离子的结构示意图:
D.镁离子的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.铅蓄电池放电时,正极每增加96g,转移电子数目为2×6.02×1023
B.反应2Cu+CO2+O2+H2O =Cu2(OH)2CO3在常温下可自发,则该反应ΔH<0
C.常温下,将稀CH3COONa溶液加水稀释后n(H+)·n(OH-)不变
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图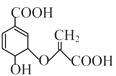 。下列关于分枝酸的叙述正确的是( )
。下列关于分枝酸的叙述正确的是( )
A.分子中含有3种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com