
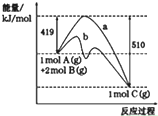
| A. | 曲线b表示使用催化剂后的能量变化 | |
| B. | 正反应活化能大于逆反应活化能 | |
| C. | 由图可知该反应的焓变△H=+91 kJ•mol-1 | |
| D. | 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ |
分析 A、催化剂能够降低反应的活化能;
B、据图分析,正反应活化能低于逆反应的活化能;
C、△H=正反应活化能-逆反应活化能;
D、固态A所含能量比气态A低.
解答 解:A、催化剂能够降低反应的活化能,所以曲线b表示使用了催化剂的能量变化,故A正确;
B、据图分析,正反应活化能低于逆反应的活化能,故B错误;
C、△H=正反应活化能-逆反应活化能=419KJ/mol-510KJ/mol=-91KJ/mol,故C错误;
D、固态A所含能量比气态A低,反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ,故D错误;
故选A.
点评 本题考查了焓变与活化能、催化剂的催化剂的催化机理、焓变的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF MgCl2 NH4Cl | B. | H2S Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH C H4 | D. | NH3 H2O CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
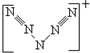 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).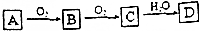
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
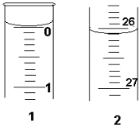 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com