
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
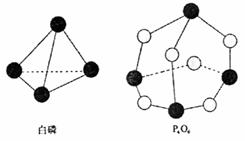 化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O=O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
A.释放1638kJ的能量
B.吸收1638kJ的能量
C.释放126kJ的能量
D.吸收126kJ的能量
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
下列说法中,正确的是
A.具有较高能量的分子是活化分子
B.活化分子间的碰撞一定是有效碰撞
C.反应的活化能大小不会影响化学反应速率
D.不同化学反应需要的活化能有可能差别很大
查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液中已检验出含大量的Fe2+、SO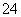 ,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH
,且pH=1。欲检验此溶液中是否大量存在以下离子:①NH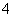 、② SiO
、② SiO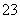 、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
A.①③⑤ B.②⑤⑥
C.①②⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
图187为离子交换膜法电解饱和食盐水的原理示意图,阴极由碳钢网制成,阳极由金属钛网做成(离子交换膜有只允许阳离子通过的阳离子交换膜与只允许阴离子通过的阴离子交换膜)。

图187
(1)若目标产品是从D处引出电解槽中的,则m电极应与电源的________极相连,n电极上的电极反应方程式为________________________________________________________;
精制食盐水应该从________口进入电解池中,从C处出来的液体成 分主要是______________。
分主要是______________。
(2) 当有10 mol某种离子透过L时,理论上电路中通过的电子为________NA;图中的交换膜L属于________(填“阳”或“阴”)离子交换膜,如果取消该交换膜,则溶液中 可能发生的副反应的化学方程式为_______________________________________________________。
可能发生的副反应的化学方程式为_______________________________________________________。
(3)为增大右侧电极区的导电能力,从B处引入的物质不是水而是某种物质的稀溶液,该物质可能是________。
a.NaCl b.NaOH c.Na2CO3 d.KOH
(4)受问题(2)中副反应的启示,人们开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图188),在制备消毒液时,b电极上的电极反应式为________________________________________________________________________。
假设食盐最终全部转化为NaClO,写出电解总反应方程式:________________________________________________________________________
________________________________________________________________________。
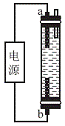
图188
查看答案和解析>>
科目:高中化学 来源: 题型:
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀的速率最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松的碱性土壤中
C.在干燥致密不透气的土壤中
D.在含炭粒较多、潮湿透气的中性土壤中
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内
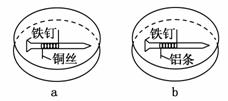 可以移动)。下列叙述正确的是( )
可以移动)。下列叙述正确的是( )
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。

(2)滴定达到终点的标志是 。
(3)产品中FeSO4.7H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠在工业生产中用途非常广泛。
(1)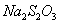 溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的
溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的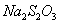 溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)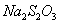 可以用作氰化物的解毒剂,工业上常用硫化碱法制备
可以用作氰化物的解毒剂,工业上常用硫化碱法制备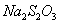 ,反应原理为:
,反应原理为:

某研究小组在实验室模拟该工业原理制备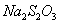 ,部分实验装置如下:
,部分实验装置如下:

①装置B的作用是检验装置A中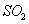 的吸收效率,则B中试剂是________________,
的吸收效率,则B中试剂是________________,
表明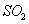 吸收效率低的实验现象是B中溶液________________________。
吸收效率低的实验现象是B中溶液________________________。
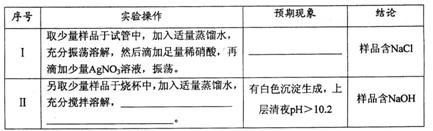
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的 含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com