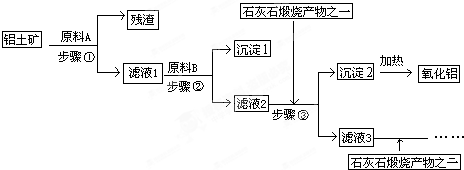
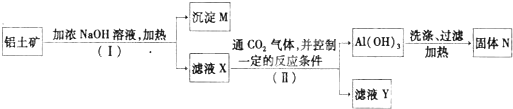
解答:解:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO
2-.步骤②应加入氢氧化钠,所以滤液1中含有Al
3+,步骤①应为加入盐酸,除去SiO
2,
(1)由上述分析可知,步骤①加入盐酸,除去SiO
2,所以原料A为盐酸,氧化铝与酸反应离子方程式为Al
2O
3+6H
+=2Al
3++3H
2O,氧化铁与盐酸反应离子方程式为Fe
2O
3+6H
+=2Fe
3++3H
2O,残渣的成分是和盐酸不反应的SiO
2,
故答案为:SiO
2;盐酸;Al
2O
3+6H
+=2Al
3++3H
2O;Fe
2O
3+6H
+=2Fe
3++3H
2O;
(2)步骤①加入过量盐酸,滤液①中含有Al
3+、Fe
3+、H
+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO
2-,反应为 H
++OH
-=H
2O,Fe
3++3OH
-=Fe(OH)
3↓,
Al
3++4OH
-=AlO
2-+2H
2O,
故答案为:NaOH; H
++OH
-=H
2O、Fe
3++3OH
-=Fe(OH)
3↓、Al
3++4OH
-=AlO
2-+2H
2O;
(3)滤液①中含有Al
3+、Fe
3+、Cl
-、H
+等,加入氢氧化钠,除去铁离子、氢离子,将铝离子转化为AlO
2-,滤液2含有AlO
2-,Cl
-、Na
+、,通入二氧化碳将偏铝酸根离子转化为氢氧化铝,所以滤液3中的离子主要有Na
+、OH
-、Cl
-、HCO
3-,步骤③通入二氧化碳与AlO
2-反应生成的沉淀为氢氧化铝,反应化学方程式为NaAlO
2+CO
2+2H
2O=Al(OH)
3↓+NaHCO
3,CaCO
3CaO+CO
2↑,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钠反应,
NaHCO
3+Ca(OH)
2═CaCO
3↓+NaOH+H
2O,所以NaOH、CaCO
3可再次被利用,即可循环使用,
故答案为:Na
+、OH
-、Cl
-、HCO
3-;NaOH、CaCO
3;
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,用NaOH溶液溶解铝土矿,则有部分SiO
2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al
2O
3混有SiO
2杂质,
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO
2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al
2O
3混有SiO
2杂质.
(5)由工业流程可知,操作①、②、③是分离固体与液体,应是过滤;检验Al(OH)
3沉淀是否完全,只要检验滤液3中是否含有AlO
2-即可.取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全,
故答案为:过滤;取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全;
(6)该铝土矿中氧化铝的百分含量用氧化铝的质量B除以铝土矿的质量A,
×100%;该小组实验结果偏大的原因可能是:
A、沉淀1为氢氧化铁,未对沉淀1进行洗涤,导致沉淀表面附有偏铝酸根离子,导致最终实验结果偏小,故A错误;
B、沉淀2为氢氧化铝,未对沉淀2行洗涤,表面附有其它杂质充当沉淀,导致最终实验结果偏大,故B正确;
C、加热灼烧沉淀2时前后两次称量结果超过0.001克,灼烧不充分,含有氢氧化铝,导致最终实验结果偏大,故C正确;
D、步骤③所得混合物在分离时有液体溅出,导致铝的偏铝酸根离子被溅出,导致最终实验结果偏小,故D错误;
故答案为:
×100%;BC;