
| A. | O | B. | F | C. | S | D. | Cl |
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
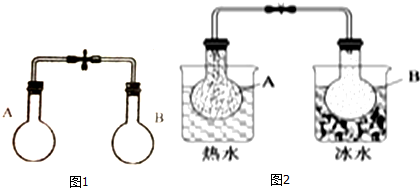
| A. | 图2中,B烧瓶颜色较深 | |
| B. | 图2中,B烧瓶与A烧瓶相比有较多的NO2 | |
| C. | 图2中B烧瓶的正反应速率比图1中B烧瓶的快 | |
| D. | 图2中A烧瓶的正反应速率比图1中A烧瓶的快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4酸性溶液 | B. | 银氨溶液 | ||
| C. | 溴水 | D. | 新制Cu(OH)2和FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
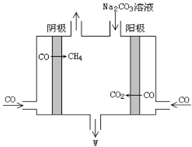 (1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(1)利用CO2与H2反应可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚--空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃有3种同分异构体 | |
| B. | 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种 | |
| C. | 含有5碳原子的饱和链烃,其一氯代物只有3种 | |
| D. | 菲的结构为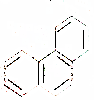 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com