
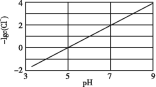
【题目】0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确的是( )
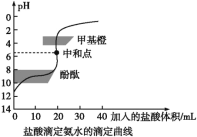
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. 当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
【答案】C
【解析】
A.用0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,恰好完全反应产生NH4Cl是强酸弱碱盐,水解使溶液显酸性,为减少滴定误差,要选择在酸性范围内变色的指示剂甲基橙,A错误;
B.两者恰好中和时产生是NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,溶液的pH<7,B错误;
C.达到滴定终点时,NH4+水解使溶液显酸性,根据质子守恒,可得:c(H+)=c(OH-)+c(NH3·H2O),C正确;
D.当滴入盐酸达40 mL时,溶液中含有等物质的量浓度的NH4Cl、NH3·H2O,根据电荷守恒可得c(NH4+)+c(H+)=c(Cl-)+c(OH-),D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是( )
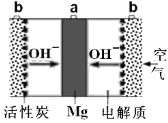
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.正极反应式为:O2+4e—+4OH—=2H2O
C.活性炭可以加快O2在正极上的反应速率
D.电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是( )
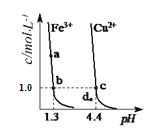
A. Ksp[Cu(OH)2]数量级为10-20
B. d点表示Cu(OH)2形成饱和溶液
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点表示Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. a和b分别连接直流电源正、负极,Cu2+向铜电极移动
D. 无论a和b是否连接,铁片均会溶解,溶液颜色都会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
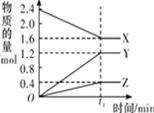
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(a+2b)kJ/mol
CuCl(s)的ΔH=(a+2b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 0.3 mol Cu与足量稀硝酸充分反应,可收集到4.48L气体
B. 由NO2和N2O4组成的混合物46g中共含有2NA个N原子
C. 常温常压下,16g甲烷分子中所含质子数为10NA
D. 0.2mol/L的NH4NO3溶液中所含N原子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com