
”¾ĢāÄæ”æ¹żŃõ»ÆøĘŹĒŅ»ÖÖ°×É«¹ĢĢ壬Ī¢ČÜÓŚĄäĖ®£¬²»ČÜÓŚŅŅ“¼£¬»ÆѧŠŌÖŹÓė¹żŃõ»ÆÄĘĄąĖĘ”£Ä³Ń§Ļ°Š”×éÉč¼ĘŌŚ¼īŠŌ»·¾³ÖŠĄūÓĆCaCl2ÓėH2O2·“Ó¦ÖĘČ”CaO2”¤8H2O£¬×°ÖĆČēĶ¼ĖłŹ¾£ŗ
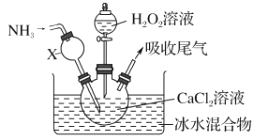
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š”×éĶ¬Ń§²éŌÄĪÄĻ×µĆÖŖ£ŗøĆŹµŃéÓĆÖŹĮæ·ÖŹżĪŖ20%µÄH2O2ČÜŅŗ×īĪŖŹŹŅĖ”£ŹŠŹŪH2O2ČÜŅŗµÄÖŹĮæ·ÖŹżĪŖ30%”£øĆŠ”×éĶ¬Ń§ÓĆŹŠŹŪH2O2ČÜŅŗÅäÖĘŌ¼20%µÄH2O2ČÜŅŗµÄ¹ż³ĢÖŠ£¬Ź¹ÓĆµÄ²£Į§ŅĒĘ÷³ż²£Į§°ō”¢½ŗĶ·µĪ¹ÜĶā£¬»¹ÓŠ_______________”£
£Ø2£©ŅĒĘ÷XµÄÖ÷ŅŖ×÷ÓĆ³żµ¼ĘųĶā£¬»¹¾ßÓŠµÄ×÷ÓĆŹĒ_________”£
£Ø3£©ŌŚ±łĖ®Ō”ÖŠ½ųŠŠµÄŌŅņŹĒ______________________”£
£Ø4£©ŹµŃ鏱£¬ŌŚČż¾±ÉÕĘæÖŠĪö³öCaO2”¤8H2O¾§Ģ壬×Ü·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________”£
£Ø5£©·“Ó¦½įŹųŗ󣬾¹żĀĖ”¢Ļ“µÓ”¢µĶĪĀŗęøÉ»ńµĆCaO2”¤8H2O”£ĻĀĮŠŹŌ¼ĮÖŠ£¬Ļ“µÓCaO2”¤8H2OµÄ×ī¼ŃŃ”ŌńŹĒ_______”£
a£®ĪŽĖ®ŅŅ“¼ b£®ÅØŃĪĖį c£®Na2SO3ČÜŅŗ d£®CaCl2ČÜŅŗ
£Ø6£©¹żŃõ»ÆøĘ£ØÓė¹żŃõ»ÆÄĘŠŌÖŹĻąĖĘ£©æÉÓĆÓŚ³¤Ķ¾ŌĖŹäÓćĆē£¬ÕāĢåĻÖĮĖ¹żŃõ»ÆøĘ¾ßÓŠ_____µÄŠŌÖŹ”£
a£®ÓėĖ®»ŗĀż·“Ó¦¹©Ńõ b£®ÄÜĪüŹÕÓćĆēŗō³öµÄCO2ĘųĢå c£®ÄÜŹ¹Ė®ĢåĖįŠŌŌöĒæ
£Ø7£©½«ĖłµĆCaO2”¤8H2O¾§Ģå¼ÓČȵ½150~160”ę£¬ĶźČ«ĶŃĖ®ŗóµĆµ½¹żŃõ»ÆøĘѳʷ”£
øĆŠ”×é²ā¶Ø¹żŃõ»ÆøĘѳʷ֊CaO2µÄ“æ¶ČµÄ·½·ØŹĒ£ŗ×¼Č·³ĘČ”0.4000g¹żŃõ»ÆøĘѳʷ£¬400”ęŅŌÉĻ¼ÓČČÖĮĶźČ«·Ö½ā³ÉCaOŗĶO2(ÉčŌÓÖŹ²»²śÉśĘųĢå)£¬µĆµ½33.60mL(ŅŃ»»ĖćĪŖ±ź×¼×“æö)ĘųĢ唣ŌņĖłµĆ¹żŃõ»ÆøĘѳʷ֊CaO2µÄ“æ¶ČĪŖ________________”£
”¾“š°ø”æÉÕ±”¢ĮæĶ² ·ĄÖ¹Čż¾±ÉÕĘæÖŠČÜŅŗ·¢Éśµ¹Īü ·ĄÖ¹ĪĀ¶Č¹żøߣ¬H2O2·Ö½ā”¢ÓŠĄūÓŚ¾§ĢåĪö³ö Ca2++H2O2+2NH3+8H2OØTCaO28H2O”ż+2NH4+ a ab 54.00%
”¾½āĪö”æ
(1)ÓĆŹŠŹŪÖŹĮæ·ÖŹżĪŖ30%µÄH2O2ČÜŅŗÅäÖĘŌ¼20%µÄH2O2ČÜŅŗ£¬æÉøł¾ŻČÜŅŗµÄĢå»ż¹ĄĖćÖŹĮ棬ÓĆÉÕ±ÅäÖĘ£¬¾Ż“Ė·ÖĪö½ā“š£»
(2)øł¾Ż°±Ęų¼«Ņ×ČÜÓŚĖ®·ÖĪö½ā“š£»
(3)·“Ó¦ĪĀ¶Č½ĻµĶ£¬æɱÜĆā¹żŃõ»ÆĒā·Ö½ā£¬½µµĶ¾§ĢåµÄČܽā¶Č£»
(4)·“Ó¦ĪļĪŖ°±Ęų”¢¹żŃõ»ÆĒāŗĶĀČ»ÆøĘ£¬Éś³ÉĪļĪŖ¹żŃõ»ÆøĘŗĶĀČ»Æļ§£¬¾Ż“ĖŹéŠ“·“Ó¦µÄĄė×Ó·½³ĢŹ½£»
(5)¹żŃõ»ÆøĘŹĒŅ»ÖÖ°×É«¹ĢĢ壬Ī¢ČÜÓŚĄäĖ®£¬²»ČÜÓŚŅŅ“¼£¬»ÆѧŠŌÖŹÓė¹żŃõ»ÆÄĘĄąĖĘ£¬¾Ż“Ė·ÖĪö½ā“š£»
(6)øł¾Ż¹żŃõ»ÆøĘ»ÆѧŠŌÖŹÓė¹żŃõ»ÆÄĘĄąĖĘ·ÖĪö½ā“š£»
(7)ÓÉŃõĘųµÄĢå»ż¼ĘĖć¹żŃõ»ÆøʵÄÖŹĮ棬½ų¶ų¼ĘĖć¹żŃõ»Æøʵēæ¶Č”£
(1)ÓĆŹŠŹŪÖŹĮæ·ÖŹżĪŖ30%µÄH2O2ČÜŅŗÅäÖĘŌ¼20%µÄH2O2ČÜŅŗ£¬æÉøł¾ŻČÜŅŗµÄĢå»ż¹ĄĖćÖŹĮ棬ÓĆÉÕ±ÅäÖĘ£¬ÅäÖĘ¹ż³ĢÖŠ£¬Ź¹ÓĆµÄ²£Į§ŅĒĘ÷³ż²£Į§°ō”¢½ŗĶ·µĪ¹ÜĶā£¬»¹ÓŠÉÕ±”¢ĮæĶ²£¬¹Ź“š°øĪŖ£ŗÉÕ±”¢ĮæĶ²£»
(2)°±Ęų¼«Ņ×ČÜÓŚĖ®£¬³¤¾±Ā©¶·ÉĻ²æĢå»ż½Ļ“󣬳żµ¼ĘųĶā£¬»¹æÉ·ĄÖ¹Čż¾±ÉÕĘæÖŠČÜŅŗ·¢Éśµ¹Īü£¬¹Ź“š°øĪŖ£ŗ·ĄÖ¹Čż¾±ÉÕĘæÖŠČÜŅŗ·¢Éśµ¹Īü£»
(3)±łĖ®Ō”æÉ·ĄÖ¹ĪĀ¶Č¹żøߣ¬Ź¹H2O2·Ö½ā”¢ĒŅĪĀ¶Č½ĻµĶŹ±ÓŠĄūÓŚ¾§ĢåĪö³ö£¬¹Ź“š°øĪŖ£ŗ·ĄÖ¹ĪĀ¶Č¹żøߣ¬H2O2·Ö½ā”¢ÓŠĄūÓŚ¾§ĢåĪö³ö£»
(4)·“Ó¦ĪļĪŖ°±Ęų”¢¹żŃõ»ÆĒāŗĶĀČ»ÆøĘ£¬Éś³ÉĪļĪŖ¹żŃõ»ÆøĘŗĶĀČ»Æļ§£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCa2++H2O2+2NH3+8H2OØTCaO28H2O”ż+2NH4+£¬¹Ź“š°øĪŖ£ŗCa2++H2O2+2NH3+8H2OØTCaO28H2O”ż+2NH4+£»
(5)¹żŃõ»ÆøĘŹĒŅ»ÖÖ°×É«¹ĢĢ壬Ī¢ČÜÓŚĄäĖ®£¬²»ČÜÓŚŅŅ“¼£¬»ÆѧŠŌÖŹÓė¹żŃõ»ÆÄĘĄąĖĘ£¬Ļ“µÓCaO28H2O£¬Ó¦±ÜĆāČܽāŗĶ±äÖŹ£¬æÉÓĆŅŅ“¼£¬ŃĒĮņĖįÄĘ¾ßÓŠ»¹ŌŠŌ£¬æÉŹ¹¹żŃõ»ÆøʱäÖŹ£¬¹Ź“š°øĪŖ£ŗa£»
(6)¹żŃõ»ÆøĘ¾ßÓŠĒæŃõ»ÆŠŌ£¬æÉÓĆӌɱ¾śĻū¶¾£¬ÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆøĘŗĶŃõĘų£¬æÉĢį¹©ŃõĘų£¬ĒāŃõ»ÆøĘæÉĪüŹÕ¶žŃõ»ÆĢ¼£¬¹Ź“š°øĪŖ£ŗab£»
(7)Éę¼°·“Ó¦ĪŖ2CaO2 ![]() 2CaO+O2£¬ÉśĘųŃõĘųµÄĪļÖŹµÄĮæĪŖ
2CaO+O2£¬ÉśĘųŃõĘųµÄĪļÖŹµÄĮæĪŖ![]() =0.0015mol£¬Ōņn(CaO2)=0.003mol£¬¹żŃõ»ÆøĘѳʷ֊CaO2µÄ“æ¶ČĪŖ
=0.0015mol£¬Ōņn(CaO2)=0.003mol£¬¹żŃõ»ÆøĘѳʷ֊CaO2µÄ“æ¶ČĪŖ![]() ”Į100%=54.00%£¬¹Ź“š°øĪŖ£ŗ54.00%”£
”Į100%=54.00%£¬¹Ź“š°øĪŖ£ŗ54.00%”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌĆŗĪŖŌĮĻæÉŗĻ³ÉŅ»ĻµĮŠČ¼ĮĻ”£
£Ø1£©ŅŃÖŖ£ŗ¢Ł2H2£Øg£©+O2£Øg£©= 2H2O£Øg£©”÷H=£483.6kJ/mol
¢ŚCH3OH(g)+H2O(g)=CO2(g)+3H2(g)”÷H=£«49.0kJ/mol
ĒėŠ“³ö¼×“¼Č¼ÉÕÉś³ÉH2O£Øg£©µÄČČ»Æѧ·½³ĢŹ½_________;
£Ø2£©Ļņ1LĆܱÕČŻĘ÷ÖŠ¼ÓČė2mol CO”¢4mol H2£¬ŌŚŹŹµ±µÄ“߻ƼĮ×÷ÓĆĻĀ£¬·¢Éś·“Ó¦£ŗ2CO£Øg£©+4H2£Øg£©![]() CH3OCH3£Øl£©+H2O£Øl£©”÷H=+71kJ/mol
CH3OCH3£Øl£©+H2O£Øl£©”÷H=+71kJ/mol
¢ŁøĆ·“Ó¦ÄÜ·ń_________×Ō·¢½ųŠŠ£ØĢī”°ÄÜ”±”¢”°²»ÄÜ”±»ņ”°ĪŽ·ØÅŠ¶Ļ”±£©
¢ŚĻĀĮŠŠšŹöÄÜĖµĆ÷“Ė·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ_________£®
a£®»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±£³Ö²»±ä
b£®COŗĶH2µÄ×Ŗ»ÆĀŹĻąµČ
c£®COŗĶH2µÄĢå»ż·ÖŹż±£³Ö²»±ä
d£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
e£®1mol COÉś³ÉµÄĶ¬Ź±ÓŠ1mol O£H¼ü¶ĻĮŃ
£Ø3£©CO2£Øg£©+3H2£Øg£©![]() CH3OH£Øg£©+H2O£Øg£©”÷H£¼0ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³·“Ó¦¹ż³ĢÖŠ²æ·ÖŹż¾ŻČēĻĀ±ķ£ŗ
CH3OH£Øg£©+H2O£Øg£©”÷H£¼0ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³·“Ó¦¹ż³ĢÖŠ²æ·ÖŹż¾ŻČēĻĀ±ķ£ŗ
·“Ó¦Ģõ¼ž | ·“Ó¦Ź±¼ä | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
ŗćĪĀ ŗćČŻ (T1”ę”¢ 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
¢Ł0”«10minÄŚ£¬ÓĆH2O£Øg£©±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv(H20)=_________mol/(L”¤min)
¢Ś“ļµ½Ę½ŗāŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=_________£ØÓĆ·ÖŹż±ķŹ¾£©£¬Ę½ŗāŹ±H2µÄ×Ŗ»ÆĀŹŹĒ_________”£
¢ŪŌŚĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬Čō30minŹ±øıäĪĀ¶ČĪŖT
£Ø4£©ÓĆ¼×ĆŃ£ØCH3OCH3£©×÷ĪŖČ¼ĮĻµē³ŲµÄŌĮĻ,ĒėŠ“³öŌŚ¼īŠŌ½éÖŹÖŠµē³Ųøŗ¼«·“Ó¦Ź½_________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. øßĪĀĻĀ£¬0.2 mol FeÓė×ćĮæĖ®ÕōĘų·“Ó¦£¬Éś³ÉµÄH2·Ö×ÓŹżÄæĪŖ0.3NA
B. ŹŅĪĀĻĀ£¬1 L pH=13µÄNaOHČÜŅŗÖŠ£¬ÓÉĖ®µēĄėµÄOH©Ąė×ÓŹżÄæĪŖ0.1NA
C. ĒāŃõČ¼ĮĻµē³ŲÕż¼«ĻūŗÄ22.4 L£Ø±ź×¼×“æö£©ĘųĢåŹ±£¬µēĀ·ÖŠĶعżµÄµē×ÓŹżÄæĪŖ2NA
D. 5NH4NO3![]() 2HNO3+4N2”ü+9H2O·“Ó¦ÖŠ£¬Éś³É28 g N2Ź±£¬×ŖŅʵĵē×ÓŹżÄæĪŖ3.75NA
2HNO3+4N2”ü+9H2O·“Ó¦ÖŠ£¬Éś³É28 g N2Ź±£¬×ŖŅʵĵē×ÓŹżÄæĪŖ3.75NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢EŹĒĒ°36ŗÅŌŖĖŲ”£ĘäÖŠAÓėBŌŚÖÜĘŚ±ķÖŠĪ»ÖĆĻąĮŚ£¬AŌ×ӵĵē×ÓÕ¼¾Ż2øöµē×Ó²ćĒŅŌ×ÓÖŠ³É¶Ōµē×ÓŹżŹĒĪ“³É¶Ōµē×ÓŹżµÄ2±¶£»BµÄ»łĢ¬Ō×ÓÓŠ7ÖÖ²»Ķ¬ŌĖ¶ÆדĢ¬µÄµē×Ó£»CŌ×ÓŌŚĶ¬ÖÜĘŚŌ×ÓÖŠŌ×Ó°ė¾¶×ī“ó(Ļ”ÓŠĘųĢå³żĶā)£»DŌ×ÓµÄLµē×Ó²ćÖŠÓŠĮ½øöĪ“³É¶Ōµē×Ó£¬ĒŅĪŽæÕ¹ģµĄ£»EÓėCĪ»ÓŚ²»Ķ¬ÖÜĘŚ£¬EŌ×ÓŗĖĶā×īĶā²ćµē×ÓŹżÓėCĻąĶ¬£¬ĘäÓąø÷²ćµē×Ó¾ł³äĀś”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ(“šĢāŹ±£¬A”¢B”¢C”¢D”¢EÓĆĖł¶ŌÓ¦µÄŌŖĖŲ·ūŗűķŹ¾)
(1)A”¢B”¢DĖÄÖÖŌŖĖŲµŚŅ»µēĄėÄÜ“ÓŠ”µ½“óĖ³ŠņĪŖ_____”£
(2)AµÄĪȶØŃõ»ÆĪļÖŠ£¬ÖŠŠÄŌ×ÓµÄŌÓ»ÆĄąŠĶĪŖ____£¬æռ乹ŠĶĪŖ_____”£
(3)CÓėµēøŗŠŌ×ī“óµÄŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÓėBµÄĒā»ÆĪļČŪ·Šµć______øüøߣ¬ŌŅņŹĒ_______”£
(4)EµÄijÖÖ»ÆŗĻĪļµÄ½į¹¹ČēĶ¼ĖłŹ¾”£
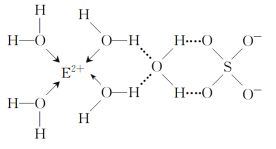
Ī¢Į£¼äµÄĻą»„×÷ÓĆ°üĄØ»Æѧ¼üŗĶ·Ö×Ó¼äĻą»„×÷ÓĆĮ¦£¬“Ė»ÆŗĻĪļÖŠø÷ÖÖĮ£×Ó¼äµÄĻą»„×÷ÓĆĮ¦ÓŠ____”£
A: Ąė×Ó¼ü B: ¹²¼Ū¼ü C: ÅäĪ»¼ü D: Ēā¼ü
(5)ŌŖĖŲ½š(Au)“¦ÓŚÖÜĘŚ±ķÖŠµÄµŚĮłÖÜĘŚ£¬ÓėEĶ¬×唣Ņ»ÖÖEŗĻ½š¾§Ģå¾ßÓŠĮ¢·½×īĆܶѻżµÄ½į¹¹£¬ŌŚ¾§°ūÖŠEŌ×Ó“¦ÓŚĆęŠÄ£¬½šŌ×Ó“¦ÓŚ¶„µćĪ»ÖĆ£¬ŌņøĆŗĻ½šÖŠEŌ×ÓÓė½šŌ×ÓŹżĮæÖ®±ČĪŖ____£»øĆ¾§ĢåÖŠ£¬Ō×ÓÖ®¼äµÄ×÷ÓĆĮ¦ŹĒ_____”£
(6)ÉĻŹö¾§Ģå¾ßÓŠ“¢Ēā¹¦ÄÜ£¬ĒāŌ×ÓæɽųČėµ½ÓÉĶŌ×ÓÓė½šŌ×Ó¹¹³ÉµÄĖÄĆęĢåæÕĻ¶ÖŠ”£Čō½«ĶŌ×ÓÓė½šŌ×ÓµČĶ¬æ““ż£¬øĆ¾§Ģå“¢ĒāŗóµÄ¾§°ū½į¹¹ÓėCaF2µÄ½į¹¹ĻąĖĘ£¬øĆ¾§Ģå“¢ĒāŗóµÄ»ÆѧŹ½Ó¦ĪŖ____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©»łĢ¬OŌ×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ_______£¬»łĢ¬PŌ×ÓŗĖĶāÕ¼¾Ż×īøßÄܼ¶µÄµē×ÓŌĘĀÖĄŖĶ¼ĪŖ_________ŠĪ£»
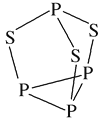
£Ø2£©P4S3æÉÓĆÓŚÖĘŌģ»š²ń£¬Ęä·Ö×Ó½į¹¹ČēĶ¼ĖłŹ¾”£P4S3·Ö×ÓÖŠĮņŌ×ÓµÄŌӻƹģµĄĄąŠĶĪŖ___________£¬ĆæøöP4S3·Ö×ÓÖŠŗ¬¹Āµē×Ó¶ŌµÄŹżÄæĪŖ_______”£
£Ø3£©Na”¢O”¢S¼ņµ„Ąė×Ó°ė¾¶Óɓ󵽊”µÄĖ³ŠņĪŖ__________
£Ø4£©SO2Ņ×ČÜÓŚĖ®£¬ŌŚĖ®ÖŠµÄČܽā¶ČĪŖ1Ģå»żµÄĖ®Čܽā40Ģå»żµÄSO2£¬ŌŅņŹĒ________”£
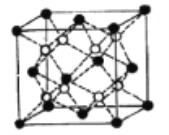
£Ø5£©Li2OµÄ¾§°ūČēĶ¼ĖłŹ¾£ØĘäÖŠ°×Ēņ“ś±ķLi£¬ŗŚĒņ“ś±ķO£©”£ŅŃÖŖ¾§°ū²ĪŹżĪŖ0.4665 nm£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬ŌņLi2OµÄĆܶČĪŖ______g”¤cm3£ØĮŠ³ö¼ĘĖćŹ½¼“æÉ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚFe3£«”¢Fe2£«ŠŌÖŹŹµŃéµÄĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A.ÓĆČēĶ¼×°ÖĆæÉŅŌÖʱø³ĮµķFe(OH)2
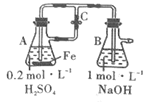
B.ÅäÖĘFeCl3ČÜŅŗŹ±£¬ĻČ½«ĀČ»ÆĢś¾§ĢåČÜÓŚ½ĻÅصÄŃĪĖįÖŠ£¬ŌŁ¼ÓĖ®Ļ”ŹĶµ½ĖłŠčŅŖµÄÅضČ
C.ĻņFeCl2ČÜŅŗÖŠ¼ÓČėÉŁĮæĢś·ŪŹĒĪŖĮĖ·ĄÖ¹Fe2£«±»Ńõ»Æ
D.FeCl3ČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ»įÉś³ÉŗģÉ«³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æt”ꏱ£¬ŅŃÖŖPdI2ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
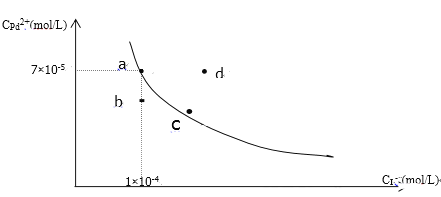
A. ŌŚt”ꏱPdI2µÄKsp=7.0”Į10-9
B. Ķ¼ÖŠaµćŹĒ±„ŗĶČÜŅŗ£¬b”¢dĮ½µć¶ŌÓ¦µÄČÜŅŗ¶¼ŹĒ²»±„ŗĶČÜŅŗ
C. ĻņaµćµÄČÜŅŗÖŠ¼ÓČėÉŁĮæNaI¹ĢĢ壬ČÜŅŗÓÉaµćĻņcµć·½ĻņŅʶÆ
D. ŅŖŹ¹dµćŅĘ¶Æµ½bµćæÉŅŌ½µµĶĪĀ¶Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æļ®”ŖĶæÕĘųČ¼ĮĻµē³ŲŹĒµĶ³É±¾øߊ§µē³Ų”£øƵē³ŲĶعżŅ»ÖÖø“ŌÓµÄĶ”°øÆŹ“”±ĻÖĻó²śÉśµēÄÜ£¬ĘäÖŠ·Åµē¹ż³ĢĪŖ2Li£«Cu2O£«H2O===2Cu£«2Li+£«2OH£”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
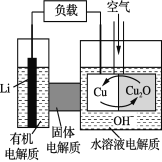
A. ·ÅµēŹ±£¬Li+Ķø¹ż¹ĢĢåµē½āÖŹĻņCu¼«ŅʶÆ
B. ĶØæÕĘųŹ±£¬Ķ±»øÆŹ“£¬²śÉśCu2O
C. ·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ:Cu2O£«2H+ +2 e- ===2Cu£«H2O
D. Õūøö·“Ó¦¹ż³ĢÖŠ£¬Ńõ»Æ¼ĮĪŖO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijøß·Ö×Ó»ÆŗĻĪļ F µÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
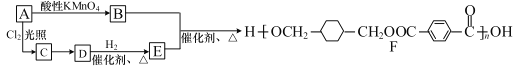
£Ø1£©A µÄ·Ö×ÓŹ½ĪŖ C8H10£¬Ōņ A”¢E µÄ½į¹¹¼ņŹ½·Ö±šŹĒ_________”¢_________”£
£Ø2£©A”śB µÄ·“Ó¦ĄąŠĶŹĒ_________”£
£Ø3£©Š“³ö C”śD µÄ·“Ó¦·½³ĢŹ½£ŗ_________ ”£
£Ø4£©H ŹĒ E µÄŅ»ÖÖĶ¬·ÖŅģ¹¹Ģ壬Ęä·Ö×ÓÖŠŗ¬ÓŠ 3 ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒā£¬ÄÜŹ¹äåĖ®ĶŹÉ«£¬1mol øĆ·Ö×Ó×ī¶ąÓė 2 mol Na ·“Ó¦£¬Š“³ö·ūŗĻĢõ¼žµÄ H ½į¹¹¼ņŹ½_________ČĪŠ“Ņ»ÖÖ£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com