
已知:25℃时Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的K比在20 mL 0.01 mol•L-1NH4Cl溶液中的Ksp小
C.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届福建省高三下热身考理综化学试卷(解析版) 题型:实验题
青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
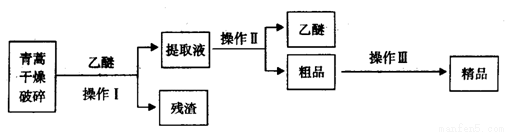
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,为加速操作I的进行,最好采用________________的方法,操作Ⅱ的名称是___________________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
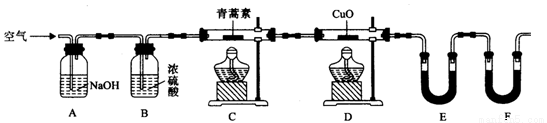
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
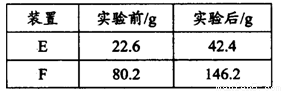
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
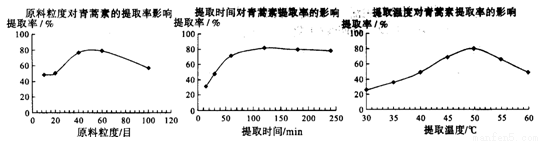
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:简答题
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
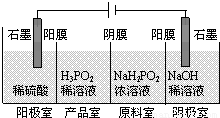
①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:选择题
己烷雌酚的一种合成路线如图:下列叙述不正确的是( )
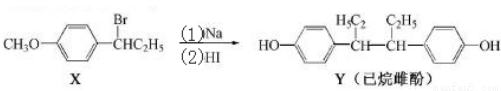
A.化合物X 的分子式为C9H13BrO B.化合物X苯环上的一溴代物有四种
C.用FeCl3溶液可鉴别化合物X和Y D.反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:实验题
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱之一。下面是它的一种实验室合成路线:
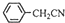 +H2O+H2SO4
+H2O+H2SO4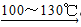
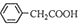 +NH4HSO4
+NH4HSO4
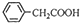 +Cu(OH)2→(
+Cu(OH)2→(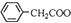 )2Cu+H2O
)2Cu+H2O
已知:苯乙腈的熔点为-23℃,不溶于水;
苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)制备苯乙酸的装置示意图如图(加热和夹持装置等略):在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是__________;
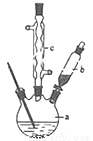
(2)将a中的溶液加热至100℃,再由b缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器c的名称是__________;其作用是__________;
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是__________,下列仪器中可用于分离苯乙酸粗品的是__________;
A.分液漏斗 |
B.漏斗 |
C.烧杯 |
D.直形冷凝管 |
E.玻璃棒
(4)提纯苯乙酸的方法是__________,最终得到44g纯品,则苯乙酸的产率是__________;
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是__________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加罗常数的值,下列说法正确的是
A.常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA
B.含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA
C.2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA
D.25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下期中化学试卷(解析版) 题型:选择题
有aL乙炔和乙烯的混合气体,在催化剂作用下与足量的H2发生加成反应,消耗H21.25aL,则乙烯与乙炔的体积比为 ( )
A.1∶1 B.2∶1 C.3∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一下第二次月考化学试卷(解析版) 题型:选择题
下列对碱金属的叙述,其中完全不正确的组合是( )
①K通常保存在煤油中,以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最强的是钾
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
A. ②③⑥ B. ②③④ C. ④⑤⑥ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com