
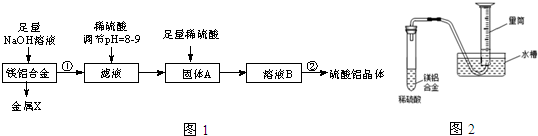
 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3;分析 本题以铝与镁的化学性质差异,选择合理的实验途径制备硫酸铝晶体的实验操作及探究镁铝混合物成分的方法,利用镁不能碱反应,用NaOH溶液先将镁铝分离并得到偏铝酸钠溶液,对滤液进行酸化得到氢氧化铝沉淀,过虑后将溶解在稀硫酸中,最后将硫酸铝溶液进行蒸发结晶,等到目标产物,至于镁铝混合物的组份测定,只要通过测定合金与足量酸反应生成的氢气量及合金的总质量即可计算;
(1)向镁铝合金中加入足量氢氧化钠溶液,Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应,采用过滤的方法进行分离,即可得到不溶物和滤液,滤液用稀硫酸酸化调整溶液pH的目的是为了促进AlO2-的水解,将其转化为Al(OH)3,通过过滤即可得到;
(2)硫酸铝是强电解质,在水中能完全电离,从其水溶液里得到晶体,通常用蒸发结晶的方法;
(3)测定镁铝合金中各组成的质量分数,可通过一定质量的合金与足量酸反应生气氢气的体积来进行计算.
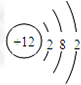
解答 解:(1)向镁铝合金中加入足量氢氧化钠溶液,Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应,发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,采用过滤的方法进行分离得到不溶性的镁,其原子结构示意图为 ,向滤液中加入稀硫酸条件溶液的pH,得到氢氧化铝固体,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
,向滤液中加入稀硫酸条件溶液的pH,得到氢氧化铝固体,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑; ;Al(OH)3;
;Al(OH)3;
(2)硫酸铝是强电解质,溶液里完全电离的电离方程式为Al2(SO4)3=2Al3++3SO42-,操作Ⅱ包含的步骤有蒸发浓缩、冷却结晶(降温结晶)、过滤洗涤、干燥,故答案为:Al2(SO4)3=2Al3++3SO42-;冷却结晶(降温结晶);
(3)某兴趣小组为测定镁铝合金中各组成的质量分数,根据图象知,能够测得氢气体积,根据金属和氢气之间的关系式分析知,设计图1示装置需要测定的数据有氢气的体积、镁铝合金的质量,故答案为:氢气的体积、镁铝合金的质量.
点评 本题考查镁铝化学性质的差异,属基础性考查,难度不大,但错误率可能较高,建议学生多关注双基学习.


科目:高中化学 来源: 题型:选择题
| A. | 自来水中通入Cl2用于杀菌、消毒是利用HClO的性质 | |
| B. | 用氯气消毒过的水可用于配制澄清石灰水溶液 | |
| C. | 氯水、液氯、氯气的成分相同,Cl2和Cl-的化学性质也相同 | |
| D. | 久制的氯水呈无色,但仍然有漂白、杀菌的功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com