
【题目】下列能用勒夏特列原理解释的是( )
A. 经粉碎的硫黄燃烧得较快、较完全
B. 实验室可以用饱和食盐水收集氯气
C. 合成NH3反应为放热反应,为提高NH3的产率,应采取升高温度的措施
D. 对H2、I2、HI平衡体系加压混和气体后颜色变深
科目:高中化学 来源: 题型:
【题目】某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL 2mol/L的NH4Cl溶液。该同学应用天平称量NH4Cl固体的质量为______g。
(2)有以下仪器:烧杯、胶头滴管、玻璃棒、量筒等玻璃仪器。
①还缺少的玻璃仪器有__________;
②使用此仪器前必须进行的一步操作是_______;
(3)该同学又用如图所示的装置收集干燥纯净的氨气并做性质实验:

①写出A处氯化铵与熟石灰反应的化学方程式:______________
②B中盛放的是__________其作用是__________
③氨水中滴加酚酞溶液变为________色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)=4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中含D物质的量至少为0.45mol
B.A的平均反应速率是![]()
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
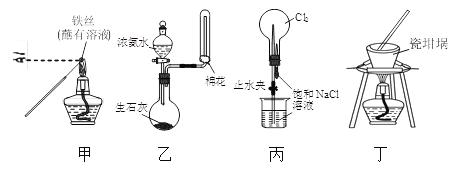
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其化学方程式是_____________。
(2)验证氯气的氧化性强于碘的实验现象是__________。
(3)B中溶液发生反应的离子方程式是______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________。
(5)过程Ⅲ实验的目的是_________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr
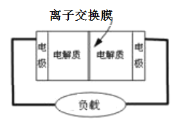
①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使酸性 KMnO4 溶液褪色②苯分子中碳原子间的距离均相等 ③苯能在一定条件下跟 H2 加成生成环己烷④经实验测得间二甲苯仅一种结构 ⑤苯在 FeBr3 存在条件下与液溴发生取代反应,但不因化学变化而使溴水褪色
A.②③⑤B.①②④⑤C.①②⑤D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com