
【题目】在一定条件下,反应N2+3H2![]() 2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
A.0.4mol·(L·min)1B.1.8mol·(L·min)1
C.1.2mol·(L·min)1D.0.6mol·(L·min)1
科目:高中化学 来源: 题型:
【题目】下列根据各概念图作出的判断,正确的是
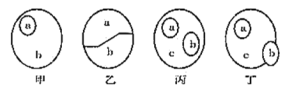
A. 在植物细胞内,甲图中a和b可以表示淀粉和葡萄糖的关系
B. 若乙中a和b分别代表DNA和RNA,则乙图可以代表病毒内的核酸
C. 丙图中a、b、c可分别表示磷脂、固醇和脂质之间的关系
D. 丁图a、b、c可分别表示蛋白质、激素和酶之间的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl和20mL0.1000mol/LCH3COOH,得到如图所示两条滴定曲线,下列说法不正确的是( )
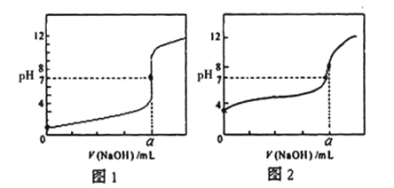
A.图1表示NaOH滴定盐酸的曲线
B.a=20mL
C.图2中,pH=7,c(CH3COO-)=c(Na+)
D.图1中,由水电离的c(H+)一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在医药卫生、高纯度金属提炼、光学仪器等领域起着至关重要的作用。从含碘化钾废液(可能还含有I2、IO3-)中回收I2,实验过程如下:
(1)确定碘的存在形式
①I2的确定:取含碘废液放入试管,加入CCl4,振荡静置,现象为_____,确定含有I2。
②IO3-的确定:取①中上层溶液,加入少量新配制的0.1mo/LFeSO4溶液,它的作用是____。振荡使之充分反应,再加入少量CCl4,CCl4层无紫色出现,说明该含碘废液中无IO3-。
(2)碘的回收
在含碘废液中加入适量的K2Cr2O7溶液和稀H2SO4,充分反应后经减压过滤得到粗碘,由粗碘提纯精制碘的装置如图:
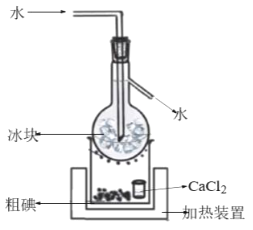
①补全得到粗碘的离子方程式:______。
□Cr2O72-+□I-+□ =□ +□Cr3++□ 。
②CaCl2的作用是__。
(3)碘的纯度分析(已知:2S2O32-+I2=2I-+S4O62-)
精确量取0.1136g精制后的碘置于250mL碘量瓶中,加入0.5gKI和30mL水,振荡至完全溶解(KI仅用于溶解)。以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黄色,加入1mL左右淀粉溶液,缓慢滴定至____,消耗Na2S2O3溶液17.26mL。碘的纯度的计算表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

(一)某化学研究小组用如图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是_____(填铁、石墨),其电极反应式为_________。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为______(忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。
下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是_____(填序号,下同),加入_____调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是:_________。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是_______。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为________,含有的化学键类型为_________________。
(2)生成物中含有一个10个电子的分子,该分子的空间构型为________,中心原子的杂化方式为________。
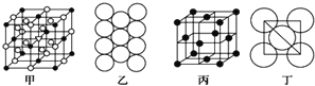
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是________(填微粒符号)。
(4)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。则一个晶胞中Al原子的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液不显色
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是化学反应中的能量变化图,该反应方程式为A2+B2==2AB,回答下列问题

(1)该反应中,反应物断键吸收的能量为_______________kJ/mol,生成物成键释放的能量为_______________kJ/mol属于_______________(填“放热”“吸热”)反应,该反应的该反应的△H=_______________(用字母写出表达式)
(2)已知反应有下列反应
①Fe+2HCl=FeCl2+H2↑ ②H2SO4+2NaOH=Na2SO4+2H2O
③CO+CuO=Cu+CO2↑ ④Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
与图片所示化学反应热效应相同的是_______________(填序号)
(3)以下说法正确的是_______________
A.中和反应是吸热反应
B.铝热反应需要在高温条件下进行,铝热反应属于吸热反应
C.放热反应发生时有可能需要加热
D.凡是放出热量的化学反应均可用来造福人类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____B(选填“>或“<”);第一电离能N>O,原因是__________________________________________。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①![]() 的空间构型为_____________,其中硫原子采用____________杂化。
的空间构型为_____________,其中硫原子采用____________杂化。
②与![]() 互为等电子体的分子的化学式为_________________(任写一种即可)
互为等电子体的分子的化学式为_________________(任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。
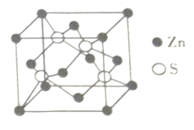
①与Zn原子距离最近的Zn原子有___________个。
②该化合物的化学式为_________________________________。
③已知该晶体的晶胞参数为a×10-12m,阿伏加德罗常数为NA。则该晶体的密度为__________________g/cm3(列式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com