
| 实验示意图 | 实验现象 | 解释 |
甲: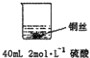 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: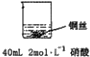 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
分析 (1)根据铜为不活泼金属,不能与稀硫酸反应来分析;因为硝酸具有强氧化性,所以铜在常温下可以与稀硝酸反应;
(2)计算出硝酸、硫酸的物质的量,分别计算出离子、硝酸根离子的物质的量,然后结合反3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O应进行判断过量情况,最后计算出反应后剩余铜的质量;
(3)①若溶液中溶质只有一种,则该溶质应该是硫酸铜,根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算出需要氢离子的物质的量,从而得出需要硫酸提供的氢离子的物质的量,据此可知硫酸的物质的量,然后根据V=$\frac{n}{c}$计算出需要硫酸溶液的体积;
②乙烧杯的中的NO3-共有:40mL×10-3L/mL×2mol/L=0.08mol,据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算出最多溶解的铜的质量,然后判断溶解的铜的最大质量是否≥8g.
解答 解:(1)甲:由于稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,所以不能将氢置换出来;乙:由于硝酸是氧化性酸,能氧化金属铜,因此实验现象是铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝,
故答案为:
| 实验示意图 | 实验现象 | 解释 |
甲: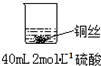 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来 | |
乙: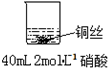 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 |
点评 本题考查了硫酸、硝酸的性质及混合物反应的计算,题目难度中等,注意掌握硫酸、硝酸的化学性质,(3)为难点、易错点,正确判断反应物过量情况为解答根据,试题培养了学生的分析、理解能力及化学计算、化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 铍原子失电子的能力比钙弱 | B. | 砹的氢化物不如碘化氢稳定 | ||
| C. | 硒酸的酸性比硫酸强 | D. | 氢氧化锶的碱性比氢氧化钙强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溶液中的离子反应
溶液中的离子反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com