
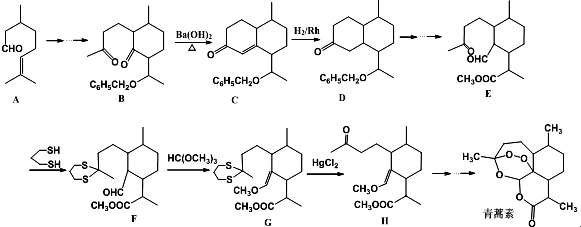
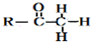 +
+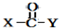 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$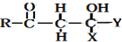
分析 (1)A.分子结构中含有过氧键,将碘离子氧化为碘单质;
B.青蒿素分子中含有酯基,具有酯基的性质;
C.青蒿素属于环状化合物,不含苯环;
D.青蒿素分子中含有酯基,具有酯的性质;
(2)由A的结构简式可知,含有的非含氧官能团为碳碳双键,A中还含有醛基,一般用溴水检验碳碳双键,但溴水可以氧化醛基,先用弱氧化剂氧化醛基,如新制氢氧化铜悬浊液、银氨溶液,再用酸中和碱,最后用溴水检验;
(3)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应,再发生消去反应生成C;
(4)M与A互为同系物,但比A少两个碳原子,A的不饱和度为2,则M分子式为C8H14O,M的同分异构体满足:①含有六元环,②能发生银镜反应,含有醛基,可以是环己烷被-CH2CHO取代,也可以是被-CH3、-CHO取代.
解答 解:(1)A.青蒿素含有-O-O-键,具有较强的氧化性,将碘离子氧化为碘单质,青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,故A错误;
B.青蒿素分子中含有酯基,具有酯基的性质,青蒿素应难溶于水,溶于乙醇、苯等,故B错误;
C.青蒿素属于环状化合物,不含苯环,不属于芳香族化合物,故C正确;
D.青蒿素分子中含有酯基,具有酯的性质,在一定条件下,青蒿素能与NaOH溶液发生反应,故D正确,
故选:CD;
(2)由A的结构简式可知,含有的非含氧官能团为碳碳双键,A中还含有醛基,一般用溴水检验碳碳双键,但溴水可以氧化醛基,先用弱氧化剂氧化醛基,如新制氢氧化铜悬浊液、银氨溶液,再用酸中和碱,最后用溴水检验,正确的顺式为:CBA,
故答案为:碳碳双键;CBA;
(3)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应产生C-OH,再发生消去反应生成产生C=C双键生成C,
故答案为:加成反应、消去反应;
(4)M与A互为同系物,但比A少两个碳原子,A的不饱和度为2,则M分子式为C8H14O,M的同分异构体满足:①含有六元环,②能发生银镜反应,含有醛基,可以是环己烷被-CH2CHO取代,也可以是被-CH3、-CHO取代,二元取代有4种,故共有5种,
故答案为:5.
点评 本题考查有机物的合成、有机物的结构与性质、限制条件同分异构体书写等,是对有机化学基础的综合考查,侧重考查学生分析推理能力,熟练掌握官能团的性质与转化,(2)注意官能团检验中醛基对碳碳双键的干扰,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.
NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:B>A>D>C | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:A>B,非金属性:C>D | D. | 离子半径:D2->C->B2+>A+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.3 mol•L-1•min-1 | B. | v(N2)=0.05 mol•L-1•s-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v(NH3)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com