
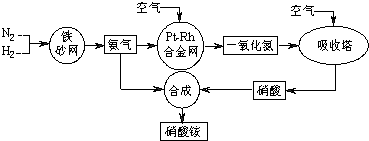
| ||
| △ |
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
| ||
| △ |
| c4(NO)?c6(H2O) |
| c(NH3)?c5(O2) |
| 28×1+2×3 |
| (1-x)(3-3x)+2x |
| 3×0.3 |
| 3 |


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
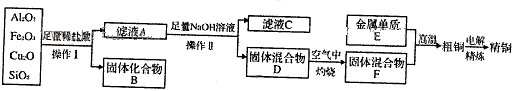
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B、该溶液中一定含有A13+、CO32-、Cl- |
| C、该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| D、Cl-可能含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
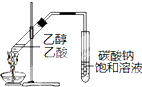
| A、配制银氨溶液:质量分数为2% 氨水中加入过量的硝酸银溶液 |
| B、制备乙酸乙酯:用如右图所示的实验装置 |
| C、鉴定溴乙烷中的溴原子:向溴乙烷中加入硝酸酸化的硝酸银溶液 |
| D、鉴别地沟油和矿物油:加入足量氢氧化钠溶液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
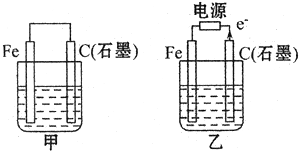 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1S22S22p63S23p64S14p5 |
| B、1S22S22p63S23p63d6 |
| C、1S22S22p63S23p64S23d4 |
| D、1S22S22p63S23P63d54S1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④ |
| C、①② | D、①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com