
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的2/3 |
| Z | 第三周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
为说明氯比硫的非金属性强,下列事实可作依据的是
A、HCl的溶解性强于H2S B、氯的最高价为+7价
C、H2S中的S2-能被Cl2氧化 D、HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于________族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是________(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是________(填序号)。
a.自然界中的含量 b. 单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d. 最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是____________________________________________________
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有______________(填序号)。
a.m、n b.m、y c.n、y
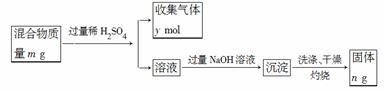 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为( )
A.1∶4 B.1∶2 C.1∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是( )
A. 硫原子的原子结构示意图:
B.NH4Cl的电子式: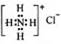
C.原子核内有10个中子的氧原子:
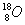
D.纯碱的化学式为NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式为 , Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液②加入NaOH溶液③加热④加入蒸馏水⑤加入HNO3酸化
A.②③⑤① B.④③⑤① C.④①⑤ D.②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
气体A、B通式分别为CnH2n+2和CnH2n-2,若用催化剂使250 mL混合气体加氢,在相同条件下需要H2 100 mL,则原混合气体中A、B两体积之比为
A.1∶2 B.1∶3 C.1∶4 D.4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com