

| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | —— | 9 550 | 11 600 |


科目:高中化学 来源:不详 题型:单选题
 ):
): +
+ ―→
―→ +
+ ,开创了人造核素的先河。下列有关说法不正确的是
,开创了人造核素的先河。下列有关说法不正确的是| A.该变化说明原子核在一般的化学反应中也能发生变化 |
| B.该变化同样遵循质量守恒定律 |
C. 是一种电中性粒子 是一种电中性粒子 |
D.对于 有:原子序数=质子数=中子数=核外电子数 有:原子序数=质子数=中子数=核外电子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:O<S<Na |
| B.稳定性:PH3>H2S>NH3 |
| C.酸性:H3PO4<H2SO4<HClO4 |
| D.碱性:Al(OH)3<Mg(OH)2<NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z2- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+的轨道表示式 |
B.Na+的结构示意图: |
| C.Na的电子排布式:1s22s22p63s1 |
| D.Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.电子的自旋磁量子数是±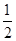 ,表示一个原子轨道中的2个电子的运动状态完全相反 ,表示一个原子轨道中的2个电子的运动状态完全相反 |
| B.磁量子数m=0的轨道都是球形的轨道 |
| C.角量子数l的可能取值是从0到n的正整数 |
| D.多电子原子中,电子的能量决定于主量子数n和角量子数l |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com