
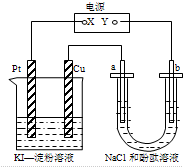
| A. | X可以是电源的负极,也可以是电源的正极 | |
| B. | 甲装置的电池反应是:2Cu2++4I-=2CuI↓+I2 | |
| C. | 乙装置a电极周围溶液变红色,pH变大 | |
| D. | 乙装置中Na+向b电极迁移 |
分析 a、b都是惰性电极,通电一段时间后,Cu电极上有气体产生,所以铜为阴极水电离产生的氢离子放电生成氢气,则a是阳极、b是阴极,所以X是正极、Y是负极,据此分析解答.
解答 解:a、b都是惰性电极,通电一段时间后,Cu电极上有气体产生,所以铜为阴极水电离产生的氢离子放电生成氢气,则a是阳极、b是阴极,所以X是正极、Y是负极,
A、X是电源的正极,故A错误;
B、甲装置铜极是水电离出的氢离子放电,生成氢气,而铜单质本身不放电,故B错误;
C、乙装置b电极是氢离子放电,生成氢气,同时产生氢氧根离子,周围溶液变红色,pH变大,故C错误;
D、乙装置中Na+向阴极b电极迁移,故D正确;
故选D.
点评 本题考查了电解原理,明确各个电极上放电的离子是解本题关键,根据各个电极上发生的反应来分析即可,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
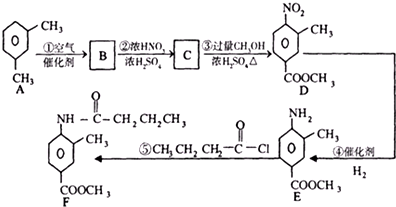
 .
.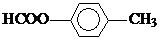 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
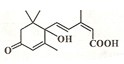 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 1mol该物质可消耗2molNaOH | ||
| C. | 分子式为C14H20O4 | D. | 1mol该物质可与3molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com