
【题目】某混合液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图所示(写出最佳答案)
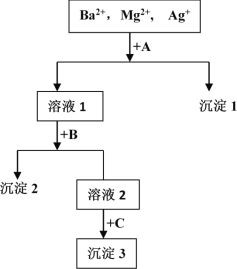
(1)沉淀的化学式:沉淀1______________,沉淀2______________,沉淀3______________;
(2)写出混合液 + A的离子方程式_____溶液1 + B的离子方程式_________。
【答案】AgCl BaSO4或Mg(OH)2 Mg(OH)2或BaSO4 Ag++Cl-=AgCl↓ Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓
【解析】
溶液含有Ba2+、Mg2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Mg(OH)2沉淀,或者过滤后在加入NaOH,可得到Mg(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,根据物质的性质书写反应的离子方程式。
(1)根据以上分析可知沉淀1是AgCl,沉淀2是BaSO4或Mg(OH)2,沉淀3是Mg(OH)2或BaSO4;
(2)混合液+A反应的离子方程式为Ag++Cl-=AgCl↓,沉淀2是BaSO4或Mg(OH)2,溶液+B反应的离子方程式为Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓。


科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子物质的量浓度与 100 mL 1 mol·L-1 的 AlCl3 溶液中氯离子物质的量浓度相等的是
A.200 mL 1 mol·L-1 的 NaClB.200 mL 2 mol·L-1 的NH4Cl
C.100 mL 3 mol·L-1 的 KClD.100 mL 2 mol·L-1 的BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜。当两装置电路中通过的电子都是1mol时,下列说法不正确的是
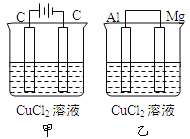
A. 溶液的质量减小程度:乙<甲
B. 溶液的导电能力变化:甲>乙
C. 甲中阴极和乙中镁电极上析出物质质量:甲=乙
D. 电极反应式:甲中阳极:![]() -2e → Cl2↑,乙中正极:
-2e → Cl2↑,乙中正极:![]() + 2e → Cu
+ 2e → Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是____。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。根据上图回答下列问题:
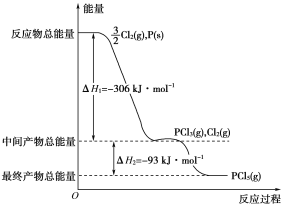
(1)P和Cl2反应生成PCl3的热化学方程式是__________________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是_________________________
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、丙烯等低碳烯烃是重要的基本化工原料,随着我国国民经济的发展,对低碳烯烃的需求日渐攀升。回答下列问题:
(1)MTP(甲醇制丙烯)工艺是目前重要的化工技术。主反应为![]()
![]() 。反应历程可按下列催化过程进行:
。反应历程可按下列催化过程进行:
![]()
![]() 则
则![]() =___________。
=___________。
(2)MTP工艺中存在等多个副反应。其他条件都相同时,在某催化剂的作用下,反应温度对甲醇转化率和产物选择性的影响如图所示。已知:
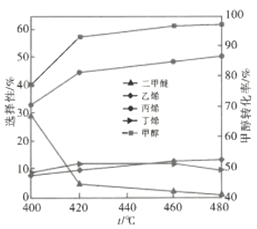
①主、副反应均为放热反应,且均为有水蒸气生成的气体分子数增加的反应
②选择性=(生成目的产物所消耗的原料量/转化掉的原料量)×100%
据图分析,若欲显著提高乙烯的选择性,不宜采取的措施是___________(填“改变温度”或“改变催化剂”);图中温度低于480℃时甲醇的转化率___________(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是___________;下列措施中可提高甲醇平衡转化率的是___________(填标号)。
A.增大甲醇浓度
B.减小压强
C.用干燥剂吸收水蒸气
D.减小反应的平衡常数
(3)恒容条件下,若反应温度为460℃,![]() 初始浓度为
初始浓度为![]() mol
mol![]() ,平衡转化率为
,平衡转化率为![]() ,丙烯的选择性为48.3%,水蒸气的平衡浓度为
,丙烯的选择性为48.3%,水蒸气的平衡浓度为![]() ,则丙烯的平衡浓度为_____________,主反应
,则丙烯的平衡浓度为_____________,主反应![]() 的平衡常数K(460℃)的计算式为___________。
的平衡常数K(460℃)的计算式为___________。
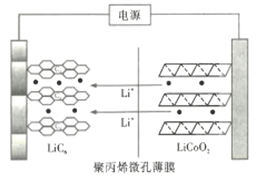
(4)丙烯可用于制备聚丙烯,聚丙烯微孔薄膜可用作锂离子电池的隔膜。某种锂离子电池充电时的示意图如图所示。![]() 中的
中的![]() 穿过隔膜向左迁移并嵌入石墨(用
穿过隔膜向左迁移并嵌入石墨(用![]() 表示)中。放电时
表示)中。放电时![]() 中的
中的![]() 又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com