
| A. | $\frac{1}{2}$、$\frac{1}{22.4}$ | B. | $\frac{1}{3}$、$\frac{1}{33.6}$ | C. | $\frac{2}{3}$、$\frac{1}{11.2}$ | D. | $\frac{3}{4}$、$\frac{1}{22.4}$ |
分析 用排气法收集氨气后,收集到的氨气不纯,含有空气,空气的平均相对分子质量为29,在标况下的密度为0.893g/cm3,混合气体的平均相对分子质量为0.893×22.4=20,氨气易溶于水,根据平均相对分子质量计算1L体积中含有氨气体积,即为进入烧瓶的液体体积,根据n=$\frac{V}{{V}_{m}}$和c=$\frac{n}{V(溶液)}$计算.
解答 解:用排气法收集氨气后,收集到的氨气不纯,含有空气,空气的平均相对分子质量为29,在标况下的密度为0.893g/cm3,混合气体的平均相对分子质量为0.893×22.4=20,
设氨气的体积为xL,空气的体积为(1-x)L,则有:$\frac{\frac{xL}{{V}_{m}}×17g/mol+\frac{(1-x)L}{{V}_{m}}×29g/mol}{\frac{1L}{{V}_{m}}}$=20,
解之得:x=$\frac{3}{4}$,则溶液的体积为$\frac{3}{4}$L,
n=$\frac{V}{{V}_{m}}$=$\frac{\frac{3}{4}L}{22.4L/mol}$=$\frac{3}{89.6}$mol,c=$\frac{n}{V(溶液)}$=$\frac{\frac{3}{89.6}mol}{\frac{3}{4}L}$=$\frac{1}{22.4}$mol/L;
故选D.
点评 本题考查物质的量的相关计算,题目难度中等,本题注意气体在标况下的密度的利用,氨气溶于水,其体积即为进入烧瓶的液体体积,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中的HCl | |
| B. | 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 验证碳酸的酸性强于硅酸 | |
| D. | 分离苯和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 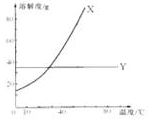 此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. | 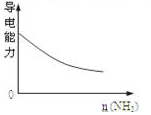 氨气通入醋酸溶液中 | D. |  N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型. ;
;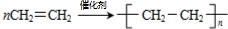 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①③④②⑥⑤ | D. | ①③②④⑥⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com