
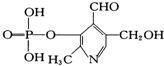
 磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )
磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )| A. | 该物质的分子式为C8H9O6NP | |
| B. | 该物质能与金属钠反应,能发生银镜反应,还能使石蕊试液变红 | |
| C. | 作为芳香族化合物,该物质可能具有芳香气味 | |
| D. | 1mol该酯与NaOH溶液反应,最多消耗3mol NaOH |
分析 由结构式可知,分子中含有醇羟基,决定具有醇的性质;含有醛基,决定具有醛的性质;含有酯基,决定具有酯的性质;含有磷酸的部分结构,具有酸的性质,以此解答该题.
解答 解:A.由结构简式可知分子式为C8H10O6NP,故A错误;
B.含有磷酸的部分结构,具有酸的性质,能使石蕊试液变红,含有醛基,能发生银镜反应,故B正确
C.不含有苯环,不是芳香族化合物,故C错误;
D.能与氢氧化钠反应的官能团有酯基,因酯基水解生成磷酸,则最多消耗3mol NaOH,故D正确.
故选AC.
点评 本题考查有机物的结构和性质,为高频常见题型和高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该类题目的关键,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | V>10 2c2=c1 | B. | V<10 2c2>c1 | C. | V>10 2c2<c1 | D. | V>10 2c2>c1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{18}$O ${\;}_{\;}^{31}$P ${\;}_{\;}^{119}$Sn | |
| B. | ${\;}_{\;}^{27}$Al ${\;}_{\;}^{19}$F ${\;}_{\;}^{12}$C | |
| C. | 元素周期表中V A族所有元素的原子 | |
| D. | 元素周期表中第一周期所有元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
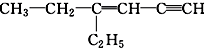 分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则a、b、c分别为( )
分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、7 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 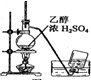 制备乙烯 | B. | 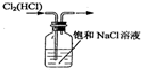 除去Cl2中的HCl | ||
| C. | 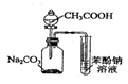 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 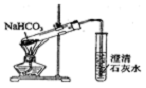 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al浓硝酸不反应 |
| C | 将盐酸滴入NaOH溶液 | 无现象 | 盐酸与氢氧化钠不反应 |
| D | 将水蒸气通过灼热铁粉 | 粉末变红 | 铁水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com