
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
分析 A、二氧化硫中含2个氧原子;
B、S6与S8均由硫原子构成;
C、标况下苯为液态;
D、粒子种类不明确.
解答 解:A、二氧化硫中含2个氧原子,故当含NA个氧原子时,二氧化硫分子个数为0.5NA个,物质的量为0.5mol,故A正确;
B、S6与S8均由硫原子构成,故6.4g混合物中含有的硫原子的物质的量n=$\frac{6.4g}{32g/mol}$=0.2mol,故个数为0.2NA个,故错误;
C、标况下苯为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、粒子种类不明确,没指明是何种粒子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
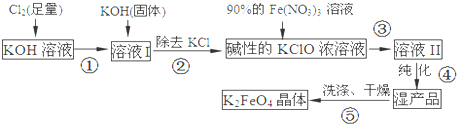
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W 与Y 可以形成离子化合物 | |
| B. | X 的简单氢化物在同主族元素的氢化物中沸点最高,说明X 的非金属性最强 | |
| C. | X 和Z 形成的原子个数l:1 的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z 的熔融氧化物来制取Z 的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 | |
| B. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 | |
| C. | 医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 | |
| D. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 用镊子取出标定为10.1g的砝码放在天平右边的托盘上 | |
| C. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平右边托盘上 | |
| D. | 将NaOH放入烧杯中,若烧杯质量为42.5g,则应将游码向右移到2.6g位置上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,则两者恰好中和,溶液的pH=7 | |
| B. | 室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,溶液pH=7 | |
| D. | 室温下,在pH=11的某溶液中,由水电离出的c(H+)可能为10-3mol/L或10-11mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com