
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
分析 (1)第一组中碳酸钠不是碱;第三组中氧化铝为两性氧化物;
(2)①2Na2O2+2H2O=4NaOH+O2反应中,每消耗2mol Na2O2生成1molO2,据方程式计算回答;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可以检验溶液中是否存在钡离子.
解答 解:(1)第一组中Na2CO3的说明是纯碱,但它属于正盐,不是碱;第二组中物质符合物质的分类知识,第三组中Al2O3能够与酸和强碱溶液反应,属于两性氧化物,不属于碱性氧化物,故答案为:Na2CO3;Al2O3;
(2)①2Na2O2+2H2O=4NaOH+O2反应中,每消耗2mol Na2O2生成1molO2,所以消耗1mol Na2O2生成0.5molO2,质量是16g,故答案为:16;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可以检验溶液中是否存在钡离子,滤液中加入硫酸钠溶液即可,故选:D;(1)Na2CO3;Al2O3.
点评 本题考查了物质的分类、氧化还原反应方程式配平、电子转移数目的计算,明确氧化还原反应得失电子守恒规律,熟悉各类物质的特点是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的NO和CO | B. | 同温度、同体积的H2和O2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠非常活泼 | |
| B. | 钠可以从硫酸铜溶液中还原出铜单质 | |
| C. | 钠在氯气中燃烧产生大量的白烟 | |
| D. | 钠元素在自然界中都是以化合态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部通过滤纸 | B. | 有丁达尔效应 | ||
| C. | 纳米材料能通过半透膜 | D. | 有电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
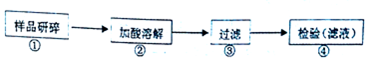
| A. | 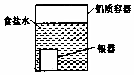 用如图装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2- | |
| B. | 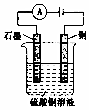 如图装置电解一段时间后,铜电极部分溶解,溶液中通离子的浓度基本不变 | |
| C. | 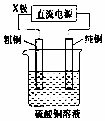 如图装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼 | |
| D. | 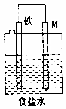 如图,图中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com