
【题目】下列说法不正确的是( )
A.乙烯、SO2能使酸性高锰酸钾溶液褪色,其褪色原理相同
B.CO和H2混合气体和氧气中充分燃烧,只要混合气体总物质的量一定,消耗氧气的量一定
C.乙醛在一定条件下能与氢气反应生成乙醇,发生了还原反应
D.CH2=CH2+HCl![]() CH3CH2Cl该有机反应应为取代反应
CH3CH2Cl该有机反应应为取代反应
【答案】D
【解析】
A.乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,SO2具有还原性,能被酸性高锰酸钾氧化,所以二者褪色原理相同,故A正确;
B. CO和H2分别在氧气中充分燃烧,化学方程式为:2CO+O2=2CO,2H2+O2=2H2O,即n(CO)或n(CO):n(O2)=2:1;所以只要混合气体总物质的量一定,消耗氧气的量一定是混合气体总物质的量的一半,故B正确;
C.乙醛在一定条件下能与氢气反应生产乙醇的方程式为CH3CHO+H2→CH3CH2OH,是加氢的反应,为还原反应,故C正确;
D.乙烯和氯化氢反应生成氯乙烷属于加成反应,CH2=CH2+HCl=CH3CH2Cl,不属于取代反应,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子轨道排布图:_________________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是___________(填序号)。
A.甲的金属性比乙强 B.乙有![]() 价
价
C.丙不可能为非金属元素 D.丁一定为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯制备乙苯的反应原理为:![]() +H2―→
+H2―→![]() ,下列说法正确的是
,下列说法正确的是
A.苯乙烯和乙苯均能使溴的CCl4溶液褪色
B.乙苯中所有原子可能处于同一平面
C.等质量的苯乙烯和乙苯完全燃烧,苯乙烯消耗O2更多
D.乙苯的一氯代物有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3)是合成其它含钴配合物的重要原料。制备流程如下:
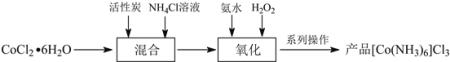
(1) “混合”步骤需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸的目的是______。
(2)流程中加入![]() 溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
(3)“氧化”步骤中应先加入氨水再加入![]() ,理由是______。
,理由是______。
(4)为测定产品中钴的含量,进行下列实验:
①称取样品4.000g于烧瓶中,加80mL水溶解,加入15.00mL 4molL-1NaOH溶液,加热至沸15~20min,冷却后加入15.00mL 6molL-1HCl溶液酸化,将![]() 转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
②加入足量KI晶体,充分反应;
③![]() 加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置连接好后,电流计指针发生了偏转,下列说法中正确的是
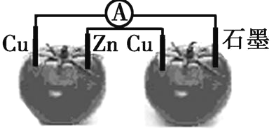
A.两个番茄及相关电极均构成了原电池
B.锌是负极
C.电子移动:锌→铜(右)→番茄→石墨→铜(左)
D.两个铜片上均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,氧化性最强的单质是___,还原性最强的单质是___。
<>(2)最高价氧化物的水化物中碱性最强的是___,酸性最强的是___,呈两性的是___。(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___。
(4)在B、C、E、F、G、H中,原子半径最大的是___。
(5)用电子式表示B和H组成化合物的形成过程___,它属于___化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是
A.Na2SO3试样![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
结论:此Na2SO3试样已变质
B.稀硫酸![]() 产生量少气泡
产生量少气泡![]() 产生大量气泡
产生大量气泡
结论:CuSO4对此反应有催化作用
C.某溶液![]() 冒着白雾
冒着白雾![]() 产生白烟,
产生白烟,
结论:此溶液为浓盐酸
D.无色试液![]() 呈黄色
呈黄色
结论:此溶液一定含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
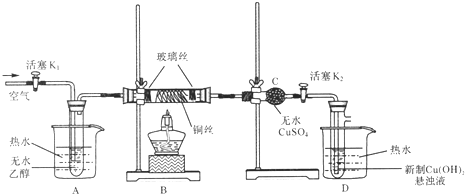
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com