
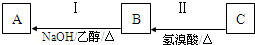
| 70 |
| 14 |
| 70 |
| 14 |
 ,属于取代反应,
,属于取代反应,| 乙醇 |
| △ |
 ,
,| 乙醇 |
| △ |
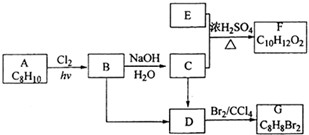
 ;
;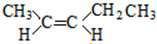 、
、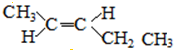 ,
,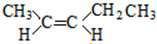 ;
;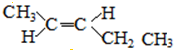 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种难溶物质比较,溶度积小的溶解度不一定小 | ||||
| B、水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 | ||||
C、向0.1mol/L的氨水中加入少量硫硫酸固体,则溶液中
| ||||
| D、0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | X | Y | Z | M | N |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A、单质与稀硫酸反应的速率快慢:M>Y>X |
| B、元素Z和N的质子数相差6 |
| C、元素Y和Z可能同周期 |
| D、相同条件下,等物质的量的单质与氢气化合放出能量的多少:N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com