
海水开发利用的部分过程如图所示。下列说法错误的是
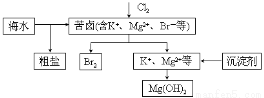
A.向苦卤中通入Cl2前,可先用稀硫酸酸化
B.工业生产中常选用KOH作为沉淀剂
C.粗盐可采用除杂和重结晶等过程提纯
D.富集溴可用热空气吹出单质溴,原因是溴单质沸点低,易挥发
科目:高中化学 来源:2016届黑龙江大庆实验中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.硅酸钠溶液与足量CO2反应: SiO32—+CO2+H2O = H2SiO3↓+CO32—
B.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2 = 2Fe3++2Cl—
C.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH– = 2AlO2–+H2O
D.碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3—+OH– = CO32—+ H2O
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:2NH3(g) N2 (g) + 3H2(g) ΔH =+92.4 kJ·mol-1
N2 (g) + 3H2(g) ΔH =+92.4 kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。
(2) 已知:2H2 (g) + O2 (g) = 2H2O(g) ΔH = - 483.6 kJ·mol-1
NH3(l)  NH3 (g) ΔH = 23.4 kJ·mol-1
NH3 (g) ΔH = 23.4 kJ·mol-1
则,反应4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(g) 的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
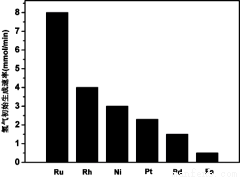

图1 图2
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K = 。
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:填空题
丹参酮ⅡA是一种治疗心血管疾病的药物,其中的一种合成路线如下:
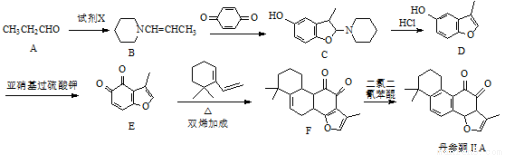
(1)丹参酮ⅡA中含氧官能团为 和 (写名称)。
(2)试剂X的分子式为C5H11N,则X的结构简式为 。
(3)A→B的反应类型为 、 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.能发生银镜反应
Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢
(5)写出以CH3CH=CHCH3和CH2=CHCHO为原料制备 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
CH3CHO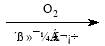 CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、SO32-、SiO32-、Br一、CO32-、.Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了3个氧化还原反应
A.①⑦③ ④ B.①③③④⑤ C.①③④⑤ D.②④⑤
④ B.①③③④⑤ C.①③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:填空题
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成的NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。

T=a℃ V=2L T=a℃ V=2L 移动活塞
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(N2)不随时间改变
D.单位时间内生成2 mol NH3的同时消耗1 mol N2
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (用初始压强P0表示)。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图所示。

①为了不影响H2O2的产 量,需要向废氨水加入适量硝酸
量,需要向废氨水加入适量硝酸 调节溶液的pH约为5,则所得废氨水溶液中
调节溶液的pH约为5,则所得废氨水溶液中 c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南云天化中学高二12月月考理化学试卷(解析版) 题型:推断题
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为: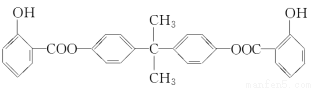
BAD的合成路线如下:
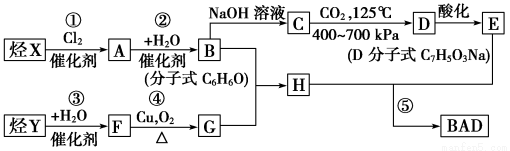
试完成下列问题:
(1)写出结构简式:Y_____ ___,D____ ____。
(2)属于取代反应的有____ _(填数字序号)。
(3)1 mol BAD最多可与含________mol NaOH的溶液完全反应。
(4)写出方程式:反应④___________ ________。
B+G―→H_____________ ___________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁葫芦岛第一高级中学高三上期中考试化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同周期元素含氧酸的酸性随核电荷数的增加而增强
B.核外电子排布相同的微粒化学性质也相同
C.Cl?、S2?、K+、Ca2+半径逐渐减小
D.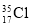 与
与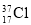 得电子能力相同
得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com