
| A�� | ���õķ�ɢϵ������Һ | B�� | ���õķ�ɢϵ�ܲ��������ЧӦ | ||
| C�� | ���õķ�ɢϵ����ͨ����ֽ | D�� | ����������ֱ����Fe2+С |
���� ���ݷ�ɢ����ֱ����С���ж����ڸ÷�ɢϵΪ�����ɢϵ��ɢϵ�����ݽ�������ʷ�����
��� �⣺��������������ɢϵ��ɢ������ֱ����5.5-36nm�����ڽ���ķ��룬�߱���������ʣ�
A����ɢ������ֱ����5.5��36nm֮�䣬���÷�ɢϵΪ���壬���Բ�����Һ����A����
B���÷�ɢ�����ڽ��壬�����ж����ЧӦ�����Ե�һ��ǿ��ͨ���˴�����ʱ����ֹ�����ͨ·����B��ȷ��
C���÷�ɢ�����ڽ��壬����ͨ����ֽ����C����
D�����������ڽ��壬������ֱ��������Һ�����ӵ�ֱ��������������ֱ����Fe2+��D����
��ѡB��
���� ���⿼�齺������ʣ��Ƚϻ��������ضԻ���֪ʶ�Ĺ��̣�ע�⽺��ı��������Ƿ�ɢ�ʵ����ȴ�С��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼�Ͷ�����̼ | B�� | 1mol̼��3mol̼ | ||
| C�� | 3mol��Ȳ��1mol�� | D�� | ���ۺ���ά�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�м���ϡ��ˮ��ƽ�������ƶ���c��OH-������ | |
| B�� | ��ˮ�м������������������ƣ�c��H+������Kw���� | |
| C�� | ���£�ʹƽ�����ƣ�c��H+����С����Һ�ʼ��� | |
| D�� | ��ˮ���ȣ�Kw����pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2C=CH2+H2$\stackrel{����}{��}$H3C-CH3 | B�� | 2CH3CH2OH+O2$\stackrel{Cu/��}{��}$2CH3CHO+2H2O | ||
| C�� | 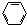 +3H2$\stackrel{Ni/��}{��}$ +3H2$\stackrel{Ni/��}{��}$ | D�� | CH4+Cl2$\stackrel{��}{��}$CH3Cl+HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������X��Y��Z��Ũ�Ȳ���ʱ��仯 | |
| B�� | �����������ܶȲ���ʱ��仯 | |
| C�� | v ��X����v ��Y��=l��2 | |
| D�� | ��λʱ������0.1 molXͬʱ����0.2molZ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2��SO4��3�T2Fe+3+3SO4-2 | B�� | Ba��OH��2�TBa2++2��OH-�� | ||
| C�� | H2SO4�T2H++SO42- | D�� | Na2CO3�TNa2++CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com