
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-=xLi++C6 | |
| C. | 充电时,若转移1mole-,石墨C6电极将增重72g | |
| D. | 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+ |
分析 放电时的反应为Li1-xCoO2+LixC6═LiCoO2+C6,Co元素的化合价降低,Co得到电子,则Li1-xCoO2为正极,LixC6为负极,LixC6失去电子得到Li+,结合原电池中负极发生氧化反应,正极发生还原反应,充电是放电的逆过程,据此解答.
解答 解:A.放电时,负极LixC6失去电子得到Li+,在原电池中,阳离子移向正极,则Li+在电解质中由负极向正极迁移,故A正确;
B.放电时,负极LixC6失去电子产生Li+,电极反应式为LixC6-xe-═xLi++C6,故B正确;
C.充电时,石墨(C6)电极变成LixC6,电极反应式为:xLi++C6+xe-═LixC6,则石墨(C6)电极增重的质量就是锂离子的质量,根据关系式:
xLi+~~~xe-
1mol 1mol
可知若转移1mole-,就增重1molLi+,即7g,故C错误;
D.正极上Co元素化合价降低,放电时,电池的正极反应为:Li1-xCoO2+xLi++xe-═LiCoO2,充电是放电的逆反应,所以充电时,阳极的电极反应式为LiCoO2-xe-═Li1-xCoO2+xLi+,故D正确;
故选:C.
点评 本题考查二次电池的充放电原理,明确电池反应中元素的化合价变化及原电池的工作原理即可解答,注意与氧化还原反应的结合,在写电极反应式时注意装置中有自由移动的Li+,C选项考查学生的仔细程度,难度适中.


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水能将分别含有 Fe3+、Al3+、Mg2+、Cu2+等阳离子的四种溶液区分开 | |
| B. | NaCl、NH3、蔗糖分别属于强电解质、弱电解质、非电解质 | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的充、放电过程互为可逆反应 | |
| B. | 放电时,电池的负极反应为 Li-e-═Li+ | |
| C. | 放电过程中,Li+向电池的负极移动 | |
| D. | 该电池可以采用醋酸、乙醇等作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol S和O2的摩尔质量都是32 g | |
| B. | 7.8g Na2S与Na2O2的混合物约含有阴离子6.02×1022个 | |
| C. | 1mol任何气体中都含有相同的原子数 | |
| D. | 22.4LCO2气体中含有3NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(OH-)=10-13mol/L的溶液:Al3+、Na+、Cl- | |
| B. | 使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、SO42- | |
| C. | 0.1 mol/L AlCl3的溶液:NH4+、AlO2-、ClO- | |
| D. | 0.1 mol/L FeCl3溶液:K+、Br-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
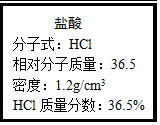 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其峰的面积比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| B. | 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量的饱和纯碱溶液,通过分液即得乙酸乙酯 | |
| C. | 除去乙醇中的少量水,加入新制生石灰,经蒸馏即得乙醇 | |
| D. | 有机物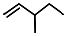 的系统名称为3-甲基-1-戊烯 的系统名称为3-甲基-1-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com