
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
分析 A.能使甲基橙变红的溶液呈酸性;
B.$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液呈酸性;
C.与Fe2+发生反应的离子不能大量共存;
D.水电离的c(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性.
解答 解:A.能使甲基橙变红的溶液呈酸性,酸性条件下AlO2-不能大量共存,故A错误;
B.$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液呈酸性,离子之间不发生任何反应,可大量共存,故B正确;
C.ClO-与Fe2+发生氧化还原反应而不能大量共存,故C错误;
D.水电离的c(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性,酸性条件下CO32-不能大量共存,碱性条件下NH4+不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨分子的电子式: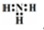 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: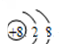 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
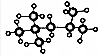 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com