
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
C.H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热;
D.稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,△H<0,故A错误;
B.中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量,和盐酸、氢氧化钠的用量无关,故B错误;
C.H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成1mol水和可溶盐的中和热,故C正确;
D.稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ,焓变为负值,则该反应的△H<-114.6 kJ•mol-1,故D错误;
故选C.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确化学反应与能力变化的关系即可解答,注意掌握盖斯定律的内容及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| W | Q | ||
| X | Y |
| A. | 简单离子半径:X<Q | B. | 气态氢化物的稳定性:Y>Q | ||
| C. | X的族序数大于周期数 | D. | Y氧化物对应水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
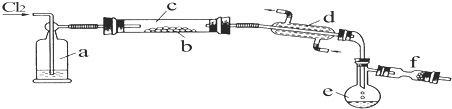
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
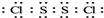 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
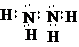 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com