
����Ŀ��Na2S2O3�ڻ�ѧ���������г����������ʣ������ֽ⣻ʵ�����Ʊ�ԭ��Ϊ2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2 �� ʵ��װ�����£�
3Na2S2O3+CO2 �� ʵ��װ�����£� 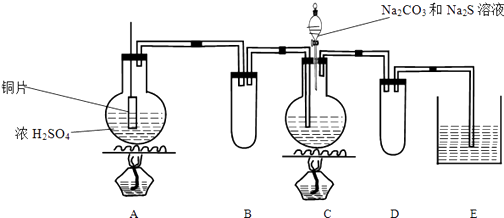
��1��A�з�����Ӧ�Ļ�ѧ����ʽ�ǣ� ��
��2��E����ʢ�Լ�����������ҪֹͣA�еĻ�ѧ��Ӧ�������Բ�ȡ�IJ����� ��
��3��B��Dװ�����ã�
��4����ͬѧ�ڼ���A����Һ���µ�ͭ˿��ڣ���ͬѧ�Ժ�ɫ������������¼��裺
�ٿ�����CuO���ڿ�����Cu2O���ۿ�����CuS
��ͬѧ��Ϊ�����һ���������������� ��
��ͬѧ���ʵ���һ����֤��ɫ���ʵ���ɣ�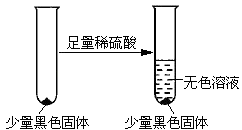
�������������������ɫ���ʵ����Ϊ���ѧʽ�� ��
��5��C��ͨ��SO2���ܹ���ԭ���� ��
��6��ʵ�����������������Һ���ղ�����������SO42�� �� �䷴Ӧ�����ӷ���ʽ�ǣ�
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+H2O
CuSO4+SO2��+H2O
��2������β����ֹ��Ⱦ��������ͭƬ����Һ���ֹͣ����
��3������ȫƿ����ֹC��E�е���Һ��������A��C��
��4��Cu2O��ש��ɫ��CuS
��5�������������������Һ�в��ȶ��ֽ�
��6��S2O32��+5H2O+4Cl2�T2SO42��+8Cl��+10H+
���������⣺Aװ���Ʊ���������Cװ���кϳ�Na2S2O3 �� �ᵼ��װ������ѹ��С��Bװ��Ϊ��ȫƿ���ã����������ж�������Ⱦ������Eװ���п���ʢ������������Һ����ʣ��Ķ�������Dװ��Ϊ��ȫƿ����ֹ��Һ��������1��Cu��Ũ�����ڼ��������·�Ӧ��������ͭ������������ˮ����Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+H2O��
CuSO4+SO2��+H2O��
���Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+H2O����2��E����ʢ�Լ������ǣ�����β����ֹ��Ⱦ������
CuSO4+SO2��+H2O����2��E����ʢ�Լ������ǣ�����β����ֹ��Ⱦ������
��ҪֹͣA�еĻ�ѧ��Ӧ�������Բ�ȡ�IJ����ǣ���ͭƬ����Һ���ֹͣ���ȣ�
���Դ��ǣ�����β����ֹ��Ⱦ��������ͭƬ����Һ���ֹͣ���ȣ���3��B��Dװ�����ã�����ȫƿ����ֹC��E�е���Һ��������A��C�У�
���Դ��ǣ�����ȫƿ����ֹC��E�е���Һ��������A��C�У���4����ͬѧ��Ϊ�����һ���������������ǣ�Cu2O��ש��ɫ�����ʵ���һ����֤��ɫ���ʣ���ɫ���岻��Һ���ᣬCuO�������ᷴӦ��CuS���������ᣬ�ʺ�ɫ����ΪCuS��
���Դ��ǣ�Cu2O��ש��ɫ��CuS����5�����������������õ������ᣬNa2S2O3�����ֽ⣬�ʶ��������ܹ�����
���Դ��ǣ������������������Һ�в��ȶ��ֽ⣻��6���������������Һ���ղ�����������SO42�� �� ��������ԭΪ�����ӣ���Ӧ���ӷ���ʽΪ��S2O32��+5H2O+4Cl2�T2SO42��+8Cl��+10H+ ��
���Դ��ǣ�S2O32��+5H2O+4Cl2�T2SO42��+8Cl��+10H+ ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijNaCl��Ʒ�п��ܺ���SO42�� �� CO32�� �� Ϊ�����������ӵĴ��ڣ���ȡ����ʵ�鲽�裺��Ʒ ![]()
![]() ����������
���������� ![]() �����������������Լ�AΪ �� BΪ���ѧʽ����������֤����Ʒ�в����� ��
�����������������Լ�AΪ �� BΪ���ѧʽ����������֤����Ʒ�в����� ��
���ں���ʵ������Ҫʹ��450mL0.5molL��1NaCl��Һ��Ϊ���Ƹ�Ũ��NaCl��Һ����ʵ�飬����������ƽ��ȡNaClg��
������NaCl��Һʱ�����������в�������ʹ����Ũ��ƫ�ߵ���
A������ʱNaCl�ѳ���
B����ƽ��������ʴ
C������ʱ���ӿ̶���
D������ҡ�Ⱥ�Һ���½����ּ�ˮ���̶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.95�洿ˮ��pH��7��˵�����ȿɵ���ˮ������
B.��ˮ�м�������ϡ���ᣬc��H+������KW����
C.��ˮ�м��백ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ���c��OH��������
D.pH=3�Ĵ�����Һ��ϡ����10����pH=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�У�ͨ������CO2 ����Һ���ֻ��ǵ���
A.����ʯ��ˮB.CaCl2��ҺC.NaAlO2��ҺD.BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ϩ�Ļ������200 mL���ڴ����������������������ӳɷ�Ӧ�������������100 mL����ԭ����������������ϩ���������(����)
A. 2��1B. 3��1C. 1��1D. 1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£���ƿװ��CO2���壬��ƿװ��SO2���壮����ƿ������������������ͬ���������ƿ�����ѹǿ֮��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO2��Һ�ڲ�ͬ�¶��¾��ɱ�����KlO3��������NaHSO3��ȫ���ļ���I2����������I2��������ʱ��������NaHSO3�ķ�Ӧ���ʣ���Ũ�Ⱦ�Ϊ0.020 molL��1��NaHSO3��Һ�����������ۣ�10.0 mL��KIO3��������������Һ40.0 mL��ϣ���¼10��55�����Һ����ʱ�䣬55��ʱδ�۲쵽��Һ������ʵ������ͼ����ͼ�����������жϲ���ȷ���ǣ� �� 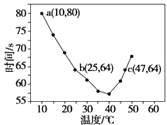
A.40��֮ǰ��40��֮����Һ������ʱ�����¶ȵı仯�����෴
B.ͼ��a���Ӧ��NaHSO3��Ӧ����Ϊ5.0��10��5 molL��1s��1
C.ͼ��b��c�����Ӧ��NaHSO3��Ӧ�������
D.40��֮���۲���������ʵ���ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�������0.1mol/L�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ���ǣ� ��
A.��Һ�е������ӵ���Ŀ����
B.����ĵ���̶�����c��H+��������
C.��Һ�� ![]() ����
����
D.��Һ�� ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϳ�����õ�˵��������� �� ��
A. ����Ҫ������� B. ����Ŀ�������ָ��������Խ��Խ��
C. ����ȼ��ȼ��ǰҪ���� D. Һ��ȼ��ȼ��ʱ������״���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com